题目内容
在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后测得c(H2)=0.008mol/L.
求:(1)该反应的平衡常数.
(2)试求达到平衡状态时H2的转化率.
求:(1)该反应的平衡常数.
(2)试求达到平衡状态时H2的转化率.
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)依据化学平衡的三段式列式计算物质的平衡浓度,结合平衡常数概念计算得到;
(2)在相同温度下,该容器中若通入H2和I2(g)各0.20mol,反应是气体体积不变的反应,所以平衡后氢气转化率不变.
(2)在相同温度下,该容器中若通入H2和I2(g)各0.20mol,反应是气体体积不变的反应,所以平衡后氢气转化率不变.
解答:
解:(1)在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后测得c(H2)=0.008mol/L,
H2 +I2 ?2HI
起始量(mol/L) 0.010 0.010 0
变化量(mol/L) 0.002 0.002 0.004
平衡量(mol/L) 0.008 0.008 0.004
平衡常数K=
=
=0.25;
答:该反应的平衡常数为0.25;
(2)H2 +I2?2HI,反应前后气体体积不变,在相同温度下,该容器中若通入H2和I2(g)各0.20mol,反应是气体体积不变的反应,所以平衡后氢气转化率不变,所以平衡后的氢气转化率=
×100%=20%,
答:达到平衡状态时H2的转化率为20%.
H2 +I2 ?2HI
起始量(mol/L) 0.010 0.010 0
变化量(mol/L) 0.002 0.002 0.004
平衡量(mol/L) 0.008 0.008 0.004
平衡常数K=
| c2(HI) |
| c(H 2)c(I 2) |
| 0.0042 |
| 0.008×0.008 |
答:该反应的平衡常数为0.25;
(2)H2 +I2?2HI,反应前后气体体积不变,在相同温度下,该容器中若通入H2和I2(g)各0.20mol,反应是气体体积不变的反应,所以平衡后氢气转化率不变,所以平衡后的氢气转化率=
| 0.002 |
| 0.01 |
答:达到平衡状态时H2的转化率为20%.
点评:本题考查了化学平衡的三段式计算应用,平衡常数、平衡转化率的概念应用计算,掌握基础是关键,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
化学与生产、生活、社会密切相关,下列说法正确的是( )
| A、煤经气化和液化两个物理过程后可变为清洁能源,这是煤综合利用的主要方法 |
| B、蛋白质、淀粉、纤维素、油脂等都能在人体内水解并提供能量 |
| C、利用风能发电、使用太阳能热水器、应用无氟制冷剂均有利于降低大气中的二氧化碳 |
| D、钢筋混凝土、玻璃钢、石棉瓦、碳纤维增强陶瓷都是常见的复合材料 |
下列气体中能用浓硫酸干燥的是( )
| A、H2S |
| B、NH3 |
| C、HI |
| D、CO2 |
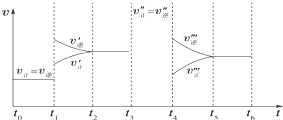 密闭容器中发生如下反应:A(g)+3B(g)?2C(g);△H<0,根据下列速率-时间图象,下列说法不正确的是( )
密闭容器中发生如下反应:A(g)+3B(g)?2C(g);△H<0,根据下列速率-时间图象,下列说法不正确的是( )| A、下列时刻所改变的外界条件是:t1升温;t3加催化剂;t4减压 |
| B、产物C的体积分数最大的时间段是t0~t1段 |
| C、上述图象中C的体积分数相等的时间段是t2~t3段与t3~t4段 |
| D、反应速率最大的时间段是t0~t1段 |
在氢硫酸溶液中,通入或加入少量的下列物质:①O2;②Cl2;③SO2;④CuSO4.能使溶液的导电能力增强的是( )
| A、①② | B、②④ | C、①④ | D、③④ |
下列物质与常用危险化学品的类别不对应的是( )
| A、CH4、汽油-易燃液体 |
| B、H2SO4、NaOH-腐蚀品 |
| C、K、Na-遇湿易燃物品 |
| D、KMnO4、K2Cr2O2-氧化剂 |