题目内容
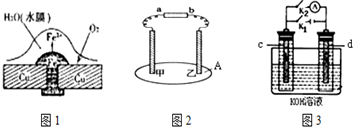
13. 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题:
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题:(1)若电解质溶液为稀硫酸,则Zn棒为原电池的负极,可观察到Cu棒的所产生现象是有气泡生成(或有气体放出),试用电极反应式表示该现象2H++2e-=H2↑.
(2)若电解质为硫酸铜溶液,则Cu棒上发生还原反应(填“氧化”或“还原”),Zn棒上发生反应的电极反应式为:Zn-2e-=Zn2+.
分析 (1)锌比铜活泼,若电解质溶液为稀硫酸,形成原电池时,锌为负极,发生氧化反应,铜为正极,发生还原反应;
(2)若电解质为硫酸铜溶液,锌被氧化生成锌离子,铜极上发生还原反应,有铜析出.
解答 解:(1)锌比铜活泼,若电解质溶液为稀硫酸,形成原电池时,锌为负极,发生氧化反应,铜为正极,发生还原反应,正极发生2H++2e-=H2↑,可观察到有气泡生成,
故答案为:负;有气泡生成(或有气体放出); 2H++2e-=H2↑;
(2)若电解质为硫酸铜溶液,锌被氧化生成锌离子,电极方程式为Zn-2e-=Zn2+,铜极上发生还原反应,有铜析出,故答案为:还原;Zn-2e-=Zn2+.
点评 本题考查原电池知识,侧重于学生的分析能力和基本理论的综合理解和运用的考查,为高频考点,注意把握原电池的工作原理以及电极方程式的书写,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列方法能达到实验要求的是( )
| A. | 用100mL量筒取5.0mL稀硫酸 | |
| B. | 用托盘天平称取2.50gNaCl固体 | |
| C. | 读数时,视线与溶液的凹液面最低点相切 | |
| D. | 在250mL容量瓶中配制240mL0.1mol/LNaOH溶液 |
1.下列物质的主要成分不是纤维的是( )
| A. | 纯棉布 | B. | 尼龙 | C. | 汽车轮胎 | D. | 晴纶 |
8.下列说法正确的是( )
| A. | 钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀 | |
| B. | 原电池反应是导致金属腐蚀的主要原因,故不能用来减缓金属的腐蚀 | |
| C. | 钢铁电化学腐蚀的两种类型主要区别在于水膜的pH不同,引起的负极反应不同 | |
| D. | 无论哪种类型的腐蚀,其实质都是金属被氧化 |
18.提高能源的利用率已成为国际能源研究的热点课题.下列相关措施使用不当的是( )
| A. | 使燃料充分燃烧 | B. | 加大能源开采力度 | ||
| C. | 加强能源利用的科技投入 | D. | 合理使用能源 |
5.下列解释实验事实的离子方程式不正确的是( )
| A. | 氧化铝与稀盐酸:Al2O3+6 H+═2 Al3++3H2O | |
| B. | 稀H2SO4与BaCl2溶液反应生成沉淀:Ba2++SO42-═BaSO4↓ | |
| C. | 用大理石与稀盐酸制备CO2:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯气与氯化亚铁溶液:Cl2+Fe2+═2Cl-+Fe3+ |
2.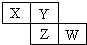 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )| A. | X的气态氢化物比Y的稳定 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Z的非金属性比Y的强 | |
| D. | Y的氢化物只有一种 |
4.一定条件下的密闭容器内发生4NH3+5O2?4NO+6H2O的反应,下列反应速率关系正确的是( )
| A. | V${\;}_{N{H}_{3}}$=$\frac{4}{5}$V${\;}_{{O}_{2}}$ | B. | V${\;}_{N{H}_{3}}$=V${\;}_{{O}_{2}}$=V${\;}_{{H}_{2}O}$ | ||
| C. | V${\;}_{{O}_{2}}$=$\frac{4}{5}$VNO | D. | V${\;}_{{O}_{2}}$=$\frac{6}{5}$V${\;}_{{H}_{2}O}$ |