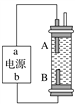
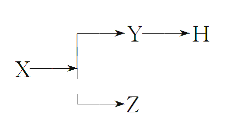
题目内容
【题目】已知有以下相互转化关系,试回答:

(1)写出B的化学式:__________,C中溶质的化学式:__________,D中溶质的化学式:__________,H的化学式:__________。
(2)写出由E转变成F的化学方程式:__________。
(3)写出由A与盐酸反应转变成B的离子方程式:__________。
(4)向G溶液加入A的离子方程式:__________。
【答案】![]() KOH
KOH![]()
![]()
![]()
![]()
![]()
【解析】
白色沉淀E在空气中变为红褐色沉淀F,则F是氢氧化铁、E是氢氧化亚铁;氢氧化铁与盐酸反应生成G,则G是氯化铁;D与硝酸酸化的硝酸银反应生成白色沉淀H,H是氯化银,所得溶液焰色反应呈紫色,则D中含有K+;D是氯化钾;B与C反应生成氢氧化亚铁和氯化钾,则B是氯化亚铁、C是氢氧化钾;A与盐酸反应生成氯化亚铁和气体,则A是铁单质,气体是氢气。
白色沉淀E在空气中变为红褐色沉淀F,则F是氢氧化铁、E是氢氧化亚铁;氢氧化铁与盐酸反应生成G,则G是氯化铁;D与硝酸酸化的硝酸银反应生成白色沉淀H,H是氯化银,所得溶液焰色反应呈紫色,则D中含有K+;D是氯化钾;B与C反应生成氢氧化亚铁和氯化钾,则B是氯化亚铁、C是氢氧化钾;A与盐酸反应生成氯化亚铁和气体,则A是铁单质,气体是氢气。根据以上分析,(1)B是氯化亚铁,化学式是![]() ,C中溶质的化学式是KOH,D中溶质的化学式是
,C中溶质的化学式是KOH,D中溶质的化学式是![]() ,H是氯化银,化学式是
,H是氯化银,化学式是![]() 。(2)氢氧化亚铁被氧气氧化为氢氧化铁,化学方程式是
。(2)氢氧化亚铁被氧气氧化为氢氧化铁,化学方程式是![]() 。(3)由铁与盐酸反应转变成氯化亚铁和氢气,反应的离子方程式是
。(3)由铁与盐酸反应转变成氯化亚铁和氢气,反应的离子方程式是![]() 。(4)氯化铁溶液加入铁粉生成氯化亚铁,反应的离子方程式是
。(4)氯化铁溶液加入铁粉生成氯化亚铁,反应的离子方程式是![]() 。
。

【题目】元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
元素代号 | A | B | C | D | E |
原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)用元素代号标出它们在元素周期表中对应的位置(以下为周期表的一部分)。
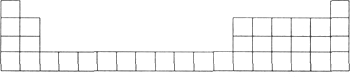
(2)B元素处于周期表中第_______周期第________族。
(3)B的最高价氧化物对应的水化物与C的最高价氧化物对应的水化物反应的离子方程式为_______________。
(4)上述五种元素的最高价氧化物对应水化物酸性最强的是__________(填化学式)。
(5)C、E形成的化合物有__________(填化学式)