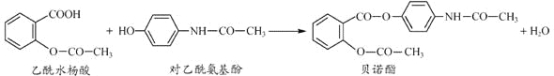
题目内容
【题目】将含有C、H、O的某有机物3.24 g装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管(A)和碱石灰干燥管(B)。测得A管增重2.16 g,B管增重9.24 g。已知有机物的相对分子质量为108。
(1)燃烧此化合物3.24 g,须消耗的氧气的质量是多少?__________
(2)求此化合物的分子式。__________
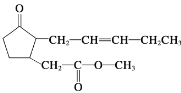
(3)该化合物1分子中存在1个苯环和1个羟基,试写出其同分异构体的结构简式和名称。_________
【答案】8.16g C7H8O  (邻甲基苯酚)、
(邻甲基苯酚)、 (间甲基苯酚)、
(间甲基苯酚)、![]() (对甲基苯酚)、
(对甲基苯酚)、 (苯甲醇)
(苯甲醇)
【解析】
(1)A管质量增加了2.16g为生成水的质量,B管增加了9.24g为生成二氧化碳的质量,根据质量守恒计算消耗氧气的质量;
(2)根据n=![]() 计算二氧化碳、水、氧气的物质的量,根据原子守恒计算3.24g有机物中C、H、O原子物质的量,进而确定最简式,结合有机物的相对分子质量为108,进而确定分子式;
计算二氧化碳、水、氧气的物质的量,根据原子守恒计算3.24g有机物中C、H、O原子物质的量,进而确定最简式,结合有机物的相对分子质量为108,进而确定分子式;
(3)该化合物的分子中有1个苯环和1个羟基,且只有一个侧链,则侧链为-CH2OH,据此写出满足条件的有机物的结构简式。
(1)A管质量增加了2.16g为生成水的质量,B管增加了9.24g为生成二氧化碳的质量,根据质量守恒可知,消耗氧气的质量=2.16g+9.24g3.24g=8.16g,
故答案为:8.16g;
(2)2.16g水的物质的量=![]() =0.12mol,n(H)=0.24mol,
=0.12mol,n(H)=0.24mol,
9.24g二氧化碳的物质的量=![]() =0.21mol,n(C)=0.21mol,
=0.21mol,n(C)=0.21mol,
8.16g氧气的物质的量=![]() =0.255mol,
=0.255mol,
3.24g有机物中n(O)=0.21mol×2+0.12mol0.255mol×2=0.03mol,
3.24g有机物中C、H、O原子物质的量之比为:0.21mol:0.24mol:0.03mol=7:8:1,
故该有机物最简式为C7H8O,
有机物的相对分子质量为108,而最简式C7H8O的式量=12×7+8+16=108,故其最简式即为分子式,即有机物分子式为:C7H8O,
故答案为:C7H8O;
(3)若该有机物含有1个苯环和羟基,C7H8O的不饱和度=![]() =4,侧链不含不饱和键,若只有1个侧链,则为CH2OH,若侧链有2个,为OH、CH3,有邻、间、对三种位置关系,故符合条件的有机物的结构简式为:
=4,侧链不含不饱和键,若只有1个侧链,则为CH2OH,若侧链有2个,为OH、CH3,有邻、间、对三种位置关系,故符合条件的有机物的结构简式为: (邻甲基苯酚)、
(邻甲基苯酚)、 (间甲基苯酚)、
(间甲基苯酚)、![]() (对甲基苯酚)、
(对甲基苯酚)、 (苯甲醇),
(苯甲醇),
故答案为: (邻甲基苯酚)、
(邻甲基苯酚)、 (间甲基苯酚)、
(间甲基苯酚)、![]() (对甲基苯酚)、
(对甲基苯酚)、 (苯甲醇)。
(苯甲醇)。

 智能训练练测考系列答案
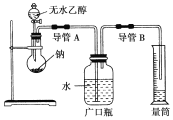
智能训练练测考系列答案【题目】实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):

H2SO4(浓)+NaBr ![]() NaHSO4+HBr↑
NaHSO4+HBr↑
CH3CH2OH+HBr![]() CH3CH2Br+H2O。有关数据见下表:
CH3CH2Br+H2O。有关数据见下表:
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红色液体 |
密度/(g·cm-3) | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)A装置的名称是______________。
(2)实验中用滴液漏斗代替分液漏斗的优点为_______________________。
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的化学方程式________________________。
(4)给A加热的目的是________________________,F接橡皮管导入稀NaOH溶液,其目的主要是___________________。
(5)图中C中的导管E的末端须在水面以下,其目的是______________________。
(6)粗产品洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0 g。从乙醇的角度考虑,本实验所得溴乙烷的产率是________________。