题目内容
配制500mL 1mol/L NaOH溶液时,下列哪些操作会使实验结果偏高________,偏低________,无影响________.
A.振荡,摇匀溶液后,发现液面低于刻度线,再补加水
B.称量时,固体放在右盘,砝码放在左盘(未用游码)
C.原容量瓶洗涤后未干燥
D.定容时俯视刻度线
E.转移时,未洗涤烧杯和玻璃棒
F.在烧杯中溶解NaOH固体后,未冷却立即将溶液注入容量瓶中.
DF AE BC
分析:分析操作对溶质的物质的量或对溶液的体积的影响,根据c=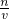 判断.
判断.
解答:A.摇匀后液面下降,一部分溶液留在瓶塞与瓶口之间,再加蒸馏水至刻度线,导致溶液体积偏大,所以溶液浓度偏低;
B.称量时,固体放在右盘,砝码放在左盘(未用游码),砝码质量等于药品质量,不影响NaOH的质量,对溶液浓度无影响;
C.最后需要定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响;
D.定容时,俯视容量瓶刻度线,使溶液的体积偏低,所以溶液浓度偏高;
E.转移时,未洗涤烧杯和玻璃棒,少量氢氧化钠沾在烧杯壁与玻璃棒上,氢氧化钠的实际质量减小,溶液浓度偏低;
F.溶液具有热胀冷缩的性质,氢氧化钠溶解放热,未冷却到室温,趁热将溶液到入容量瓶,并配成了溶液,会导致溶液体积偏小,溶液浓度偏高;
故答案为:偏高的是DF,偏低的是AE,无影响的是BC.
点评:考查溶液的配制误差分析,难度不大,关键理解溶液配制原理,分析操作对溶质的物质的量或对溶液的体积的影响,根据c=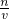 判断.
判断.
分析:分析操作对溶质的物质的量或对溶液的体积的影响,根据c=
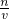 判断.
判断.解答:A.摇匀后液面下降,一部分溶液留在瓶塞与瓶口之间,再加蒸馏水至刻度线,导致溶液体积偏大,所以溶液浓度偏低;
B.称量时,固体放在右盘,砝码放在左盘(未用游码),砝码质量等于药品质量,不影响NaOH的质量,对溶液浓度无影响;
C.最后需要定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响;
D.定容时,俯视容量瓶刻度线,使溶液的体积偏低,所以溶液浓度偏高;
E.转移时,未洗涤烧杯和玻璃棒,少量氢氧化钠沾在烧杯壁与玻璃棒上,氢氧化钠的实际质量减小,溶液浓度偏低;
F.溶液具有热胀冷缩的性质,氢氧化钠溶解放热,未冷却到室温,趁热将溶液到入容量瓶,并配成了溶液,会导致溶液体积偏小,溶液浓度偏高;
故答案为:偏高的是DF,偏低的是AE,无影响的是BC.
点评:考查溶液的配制误差分析,难度不大,关键理解溶液配制原理,分析操作对溶质的物质的量或对溶液的体积的影响,根据c=
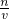 判断.
判断. 
练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
用15mol/L HNO3溶液配制500mL 1mol/L HNO3溶液时,不需要用到的仪器是( )
| A、烧杯 | B、胶头滴管 | C、天平 | D、500mL容量瓶 |