题目内容
8.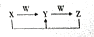 A、B、C、D、E均是常见短周期元素,其在周期表中的位置如图.
A、B、C、D、E均是常见短周期元素,其在周期表中的位置如图. | A | |||||
| B | C | D | |||
| E | |||||
(2)A与C可形成多种10电子微粒,其中分子为NH3,离子为NH4+.
(3)C、D、E的简单离子的半径大小顺序为N3->O2->Na+;
(4)A与C可形成两种常见的化合物,化合物P(相对分子质量为17)和化合物Q(相对分子质量为32).
①写出Q的结构式:
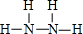
②P的水溶液可作腐蚀剂H2O2的消除剂,其反应物不污染环境,其化学方程式为2NH3.H2O+3H2O2=N2↑+8H2O.
(5)由A、B、C、D、E四种元素中的二种或二种以上元素组成的化合物X、Y、Z、W有如下转化关系:
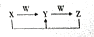 ,其中Y和Z在水溶液中存在的微粒种类相同.
,其中Y和Z在水溶液中存在的微粒种类相同.①X化合物中含有的化学键类型有离子键、共价键.
②反应X+Z→Y的离子方程式为HCO3-+OH-=CO32-+H2O.
③Y的水溶液中离子浓度的大小顺序是c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
分析 A、B、C、D、E均是常见短周期元素,由元素在在周期表中的位置,可知A为H元素,B为C元素,C为N元素,D为O元素,E为Na.
(1)用于测定文物年代的同位素是C-14;
(2)H与N可形成多种10电子微粒,其中分子为氨气、离子为铵根离子;
(3)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
(4)H与N可形成两种常见的化合物,化合物P(相对分子质量为17)和化合物Q(相对分子质量为32),则P为NH3、Q为N2H4.
①N2H4中N原子与H原子之间形成1对共用电子对,N原子之间形成1对共用电子对;
②NH3的水溶液可作腐蚀剂H2O2的消除剂,其反应物不污染环境,应生成氮气与水;
(5)四种元素中的二种或二种以上元素组成的化合物X、Y、Z、W,X与Y可以连续发生反应生成Z,而X与Z反应得到Y,可推知X为NaOH,W为CO2,Y为Na2CO3,Z为NaHCO3.
解答 解:A、B、C、D、E均是常见短周期元素,由元素在在周期表中的位置,可知A为H元素,B为C元素,C为N元素,D为O元素,E为Na.
(1)由元素在周期表中位置,可知D为O元素,用于测定文物年代的同位素是146C,故答案为:O;146C;
(2)H与N可形成多种10电子微粒,其中分子为NH3、离子为NH4+,故答案为:NH3;NH4+;
(3)N3-、O2-、Na+离子电子层结构相同,核电荷数越大离子半径越小,故离子半径:N3->O2->Na+,故答案为:N3->O2->Na+;
(4)H与N可形成两种常见的化合物,化合物P(相对分子质量为17)和化合物Q(相对分子质量为32),则P为NH3、Q为N2H4.
①N2H4中N原子与H原子之间形成1对共用电子对,N原子之间形成1对共用电子对,其结构式为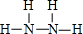 ,故答案为:
,故答案为: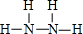 ;
;
②NH3的水溶液可作腐蚀剂H2O2的消除剂,其反应物不污染环境,应生成氮气与水,反应方程式为:2NH3.H2O+3H2O2=N2↑+8H2O,故答案为:2NH3.H2O+3H2O2=N2↑+8H2O;
(5)四种元素中的二种或二种以上元素组成的化合物X、Y、Z、W,X与Y可以连续发生反应生成Z,而X与Z反应得到Y,可推知X为NaOH,W为CO2,Y为Na2CO3,Z为NaHCO3.
①X为NaOH,化合物中含有的化学键类型有:离子键、共价键,故答案为:离子键、共价键;
②反应X+Z→Y的离子方程式为:HCO3-+OH-=CO32-+H2O,故答案为:HCO3-+OH-=CO32-+H2O;
③Na2CO3的水溶液中CO32-离子水解,溶液呈碱性,碳酸氢根继续水解,溶液中水电离也产生氢氧根离子,故溶液中c(OH-)>c(HCO3-),而水电电离微弱,氢离子浓度远小于碳酸氢根离子浓度,故溶液中离子浓度的大小顺序是c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),
故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
点评 本题考查结构性质位置关系应用、无机物推断等,关键是熟练掌握元素周期表,(5)中离子浓度大小比较为易错点,注意掌握离子浓度比较.

 名校课堂系列答案
名校课堂系列答案| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| B. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ | |
| C. | AlCl3溶液中加入过量的氨水:Al3++4OH-=AlO2-+2H2O | |
| D. | 向NaHCO3溶液中加入过量Ca(OH)2溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| A. | NO | B. | NO2 | C. | HCl | D. | NH3 |
| A. | 硫酸镁晶体分解反应是放热反应 | B. | 氯化镁水解是熵增反应 | ||
| C. | 硫酸镁晶体分解反应是熵减反应 | D. | 氯化镁分解放热比硫酸镁少 |
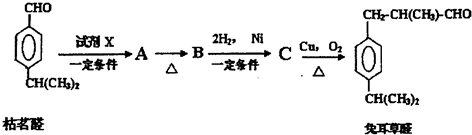
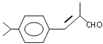 ;检验B中的官能团时,需先加入的试剂是新制氢氧化铜悬浊液;酸化后,再加入的试剂是溴水或高锰酸钾溶液.
;检验B中的官能团时,需先加入的试剂是新制氢氧化铜悬浊液;酸化后,再加入的试剂是溴水或高锰酸钾溶液. .
.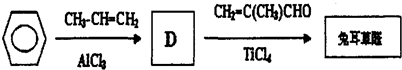
 .D→兔耳草醛的反应类型是加成反应.
.D→兔耳草醛的反应类型是加成反应. 、
、 .
.