题目内容
(1)在反应2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O中,还原剂是 .并用双线桥或单线桥表示出电子转移的方向和数目.
(2)浓盐酸在反应KClO3+HCl→KCl+ClO2+Cl2+ (补充完整)中显示出来的性质是 .
(3)一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1molCr3+反应所需PbO2的物质的量为 .
(2)浓盐酸在反应KClO3+HCl→KCl+ClO2+Cl2+
(3)一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1molCr3+反应所需PbO2的物质的量为
考点:氧化还原反应
专题:氧化还原反应专题
分析:(1)该反应中Mn元素化合价由+7价变为+2价、Br元素化合价由-1价变为0价,失电子化合价升高的反应物是还原剂;
(2)根据元素守恒知,生成物还有H2O,该反应中HCl中部分Cl化合价由-1价变为0价、部分Cl元素化合价不变;
(3)该反应中Pb元素化合价由+4价变为+2价、Cr元素化合价由+3价变为+6价,根据转移电子守恒计算二氧化铅的物质的量.
(2)根据元素守恒知,生成物还有H2O,该反应中HCl中部分Cl化合价由-1价变为0价、部分Cl元素化合价不变;
(3)该反应中Pb元素化合价由+4价变为+2价、Cr元素化合价由+3价变为+6价,根据转移电子守恒计算二氧化铅的物质的量.
解答:
解:(1)该反应中Mn元素化合价由+7价变为+2价、Br元素化合价由-1价变为0价,所以HBr为还原剂,
其电子转移方向和数目为 ,故答案为:
,故答案为:
HBr; ;
;
(2)根据元素守恒知,生成物还有H2O,该反应中HCl中部分Cl化合价由-1价变为0价、部分Cl元素化合价不变,所以浓盐酸体现酸性和还原性,故答案为:H2O;酸性和还原性;
(3)该反应中Pb元素化合价由+4价变为+2价、Cr元素化合价由+3价变为+6价,根据转移电子相等得PbO2的物质的量=
=1.5mol,
故答案为:1.5mol.
其电子转移方向和数目为
 ,故答案为:
,故答案为:HBr;
 ;
;(2)根据元素守恒知,生成物还有H2O,该反应中HCl中部分Cl化合价由-1价变为0价、部分Cl元素化合价不变,所以浓盐酸体现酸性和还原性,故答案为:H2O;酸性和还原性;
(3)该反应中Pb元素化合价由+4价变为+2价、Cr元素化合价由+3价变为+6价,根据转移电子相等得PbO2的物质的量=
| 1mol×3 |
| 2 |
故答案为:1.5mol.
点评:本题考查了氧化还原反应,根据元素化合价变化再结合方程式中各个物理量之间的关系式分析解答,题目难度不大.

练习册系列答案
相关题目
把100mL的2mol/LNaOH溶液,100mL、2mol/L的H2SO4溶液以及一定量的氨水混合,所得的溶液使酚酞试液显浅红色,则溶液中离子浓度关系正确的是( )
| A、C(SO42-)=C(Na+)>C(NH4+)>C(OH-)>C(H+) |
| B、C(Na+)>C(SO42-)>C(NH4+)>C(OH-)>C(H+) |
| C、C(NH4+)>C(SO42-)=C(Na+)>C(OH-)>C(H+) |
| D、C(H+)+C(NH4+)+C(Na+)=C(OH-)+C(SO42-) |
如果某元素的化合价由化合态变为游离态,则它( )
| A、有可能化合价升高,也有可能化合价降低 |
| B、化合价升高 |
| C、由高价变为零价 |
| D、化合价降低 |
下列说法中正确的是( )
| A、2gH2所占有的体积是22.4L |
| B、11.2LO2的质量是16g |
| C、标准状况下,22.4LH2O含有6.02×1023个H2O分子 |
| D、常温下压下32gO2与标准状况下22.4LN2含有相同的分子数 |
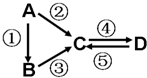 A、B、C、D均为常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为常见的纯净物,A是单质.它们之间有如下的反应关系: