题目内容
11.下列关于分子组成为CxHy的烷、烯、炔烃的说法中错误的是( )| A. | 当分子式中的x≤4时,上述烃在常温常压下均为气体 | |
| B. | 分子式中的y一定为偶数 | |
| C. | 1mol的上述烃完全燃烧时,耗氧($\frac{x+y}{4}$)mol | |
| D. | 150℃时,在密闭的容器中完全燃烧后,测得的压强一定比燃烧前增加 |
分析 A、烷、烯、炔烃中,碳原子数≤4时,常温下一般为气体;
B、根据中心碳原子形成的共价键数目进行分析;
C、完全燃烧时,1molC原子消耗1mol氧气、1mol氢原子消耗$\frac{1}{4}$mol氧气,所以1molCxHy完全燃烧消耗(x+$\frac{y}{4}$)mol氧气;
D、150℃时水为气体,根据CxHy燃烧的通式对气体体积变化进行判断.
解答 解:A、对应烷烃、烯烃和炔烃中,碳原子数目≤4时,常温下都是气体,故A正确;
B、烷、烯、炔烃分子中,中心原子C的共价键数为4,所以烃中氢原子数都是偶数,故B正确;
C、烃燃烧时,1molC原子消耗1mol氧气、1mol氢原子消耗$\frac{1}{4}$mol氧气,所以1molCxHy完全燃烧消耗(x+$\frac{y}{4}$)mol氧气,故C正确;
D、150℃时水的状态为气体,1molCxHy完全燃烧消耗(x+$\frac{y}{4}$)mol氧气,同时生成xmol二氧化碳、$\frac{y}{2}$mol水,当满足:1+(x+$\frac{y}{4}$)<x+$\frac{y}{2}$,即y>4时,反应后气体总压强增加,故D错误;
故选D.
点评 本题以烃为载体考查方程式的计算、有机物分子组成等知识点,为高频考点,注意掌握烷、烯、炔烃的组成与性质,明确常温下呈气态的烃的情况,能够根据烃的燃烧通式判断其燃烧情况,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.下列有关实验说法正确的是( )
| A. | 在“镀锌铁皮厚度测量”实验中,当锌在酸中完全溶解后,产生氢气的速率会显著减慢,可借此判断镀锌铁皮中锌镀层是否完全反应 | |
| B. | 用标准NaOH溶液测定食醋总酸含量时应该使用甲基橙作为指示剂 | |
| C. | 硫酸亚铁铵晶体制备实验的最后一步是将溶液蒸发到有大量晶体析出,用余热蒸干即可得产物 | |
| D. | 将3-4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸,检验火柴头中是否含有氯元素 |
19.X、Y是同周期非金属元素,已知X原子比Y原子的原子半径大,则下列叙述正确的是( )
| A. | X的最高价氧化物对应的水化物的酸性比Y的强 | |
| B. | X的阴离子比Y的阴离子的还原性强 | |
| C. | X原子的得电子能力比Y原子强 | |
| D. | X的气态氢化物比Y的气态氢化物稳定 |
6.中草药秦皮中含有的七叶树内酯(每个折点表示一个碳原子,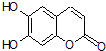 氢原子未画出),具有抗菌作用.若1mol七叶树内酯与NaOH溶液完全反应,则消耗的NaOH的物质的量为( )
氢原子未画出),具有抗菌作用.若1mol七叶树内酯与NaOH溶液完全反应,则消耗的NaOH的物质的量为( )
 氢原子未画出),具有抗菌作用.若1mol七叶树内酯与NaOH溶液完全反应,则消耗的NaOH的物质的量为( )
氢原子未画出),具有抗菌作用.若1mol七叶树内酯与NaOH溶液完全反应,则消耗的NaOH的物质的量为( )| A. | 2 mol | B. | 3 mol | C. | 4 mol | D. | 1mol |
16.下列有关叙述正确的是( )
| A. | 标准状况下,11.2 L苯中含有分子的数目为0.5NA | |
| B. | 制乙烯时,用排水法或向上排空气法收集气体 | |
| C. | 乙烯可作水果的催熟剂 | |
| D. | 78 g苯含有碳碳双键的数目为3NA |
3.I.有X、Y、Z、R四种短周期元素,Y、Z、R同周期.相关信息如下:
(1)Z元素在周期表的位置是第三周期第VIIA族,Y、Z、R简单离子的半径从大到小的顺序是S2->Cl->Na+(用离子符号表示);
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水蒸气可形成一种常见的漂白性物质.则甲的结构式为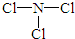 ;
;
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为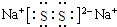 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2 .
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2 .
II.元素X与氢可形成多种化合物,如丙、丁、戊.
(1)丙与醋酸类似,为一元弱酸,对热十分稳定但受撞击就爆炸.8.6g丙爆炸分解生成H2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2 ;
(2)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H;
(3)戊在高温条件下能还原Fe2O3,生成两种单质,写出该反应的化学方程式2NH3+Fe2O3$\frac{\underline{\;高温\;}}{\;}$N2+2Fe+3H2O,有人提出生成的产物中可能还有FeO,请设计实验方案验证(用化学方法)取固体生成物ag与足量盐酸反应,测定生成气体标况的体积为VL,若V<$\frac{a}{56}×22.4$,则含FeO,反之则无;或者取一定质量固体生成物与足量H2(或CO)共热充分反应,若质量减少则含FeO,反之则无.
| 相关信息 | |
| X | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得X的单质 |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水蒸气可形成一种常见的漂白性物质.则甲的结构式为
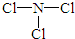 ;
;(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为
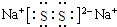 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2 .
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2 .II.元素X与氢可形成多种化合物,如丙、丁、戊.
(1)丙与醋酸类似,为一元弱酸,对热十分稳定但受撞击就爆炸.8.6g丙爆炸分解生成H2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2 ;
(2)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H;
(3)戊在高温条件下能还原Fe2O3,生成两种单质,写出该反应的化学方程式2NH3+Fe2O3$\frac{\underline{\;高温\;}}{\;}$N2+2Fe+3H2O,有人提出生成的产物中可能还有FeO,请设计实验方案验证(用化学方法)取固体生成物ag与足量盐酸反应,测定生成气体标况的体积为VL,若V<$\frac{a}{56}×22.4$,则含FeO,反之则无;或者取一定质量固体生成物与足量H2(或CO)共热充分反应,若质量减少则含FeO,反之则无.
20. 已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如下所示,1mol 该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为( )
已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如下所示,1mol 该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为( )
 已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如下所示,1mol 该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为( )
已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如下所示,1mol 该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为( )| A. | 5 mol | B. | 6 mol | C. | 7 mol | D. | 8 mol |
1.如表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白:
(1)在这些元素中,(用元素符号填写,下同)最活泼的金属元素是Na;最活泼的非金属元素是F;最不活泼的元素是Ar.
(2)这些元素的最高价氧化物对应的水化物中酸性最强的是HClO4;能形成两性氢氧化物的元素是Al.
(3)元素的非金属性②大于⑥;氢化物的稳定性⑥小于⑦(填“大于”“小于”或“等于”)
(4)⑥的元素符号为S,原子结构示意图为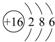
(5)④和⑦形成的化合物的电子式为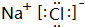 .
.
(6)写出④元素单质与水反应的离子方程式2Na+2H2O═2Na++2OH-+H2↑
(7)写出④的最高价氧化物对应的水化物与⑤的最高价氧化对应的水化物反应的化学方程式Al(OH)3+NaOH═NaAlO2+2H2O.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)这些元素的最高价氧化物对应的水化物中酸性最强的是HClO4;能形成两性氢氧化物的元素是Al.
(3)元素的非金属性②大于⑥;氢化物的稳定性⑥小于⑦(填“大于”“小于”或“等于”)
(4)⑥的元素符号为S,原子结构示意图为

(5)④和⑦形成的化合物的电子式为
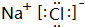 .
.(6)写出④元素单质与水反应的离子方程式2Na+2H2O═2Na++2OH-+H2↑
(7)写出④的最高价氧化物对应的水化物与⑤的最高价氧化对应的水化物反应的化学方程式Al(OH)3+NaOH═NaAlO2+2H2O.



