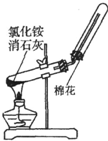
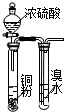
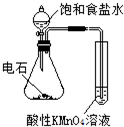
题目内容
7.实验室常用浓盐酸和二氧化锰反应来制取少量氯气,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,取8.7g的MnO2与足量的浓盐酸发生反应制取氯气.计算:(1)标准状况下生成Cl2的体积为2.24L;
(2)反应生成的MnCl2的物质的量为0.1mol;
(3)若向反应后的剩余溶液中,加入足量AgNO3溶液,生成沉淀57.4g,计算原浓盐酸中所含HC1的物质的量.
分析 (1)8.7g的MnO2,n(MnO2)=$\frac{8.7g}{87g/mol}$=0.1mol,将其物质的量代入方程式计算氯气;
(2)根据方程式计算反应生成的MnCl2的物质的量;
(3)加入足量AgNO3溶液,生成沉淀57.4g,沉淀为AgCl,结合Cl原子守恒可知,n(HCl)=2n(Cl2)+n(AgCl),以此计算.
解答 解:8.7g的MnO2,n(MnO2)=$\frac{8.7g}{87g/mol}$=0.1mol,设生成氯气为xL,参加反应的MnCl为ymol,则
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
1 4 1 22.4L
0.1mol y x
$\frac{1}{0.1}$=$\frac{1}{y}$=$\frac{22.4L}{x}$
解得x=2.24L,y=0.1mol,
故答案为:(1)产生的氯气在标准状况下的体积为2.24L;
(2)参加反应的MnCl物质的量有0.1mol;
(3)加入足量AgNO3溶液,生成沉淀57.4g,沉淀为AgCl,结合Cl原子守恒可知,n(HCl)=2n(Cl2)+n(AgCl),
n(AgCl)=$\frac{57.4g}{143.5g/mol}$=0.4mol,n(Cl2)=0.1mol,
n(HCl)总=0.4mol+0.1mol×2=0.6mol,
故答案为:原浓盐酸的物质量为0.6mol.
点评 本题考查化学反应方程式的计算,为高频考点,把握方程式计算的格式及对应关系为解答的关键,侧重分析能力及计算能力的考查,注意原子守恒的应用,题目难度不大.

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案| A. | 11.2LCO和N2混合气体中含有的分子数是0.5NA | |
| B. | 在氯气参与的反应中,22.4L(标况)氯气完全反应得到的电子数一定为0.2NA | |
| C. | 1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 | |
| D. | l L l mol•L-1的NaClO溶液中含有ClO-的数目小于NA |
| A. | 天然气 | B. | 氢气 | C. | 水煤气 | D. | 煤炭 |
| A. | 由于冰得到二氧化碳气体 | |
| B. | 胆矾加热失去结晶水 | |
| C. | 烧瓶中盛有二氧化氮气体,加入活性炭后,红棕色逐渐消失 | |
| D. | 铜导电. |
 某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).部分阳离子以氢氧化物形式沉淀时的pH如表:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
操作a中需要的玻璃仪器烧杯、漏斗、玻璃棒
(2)“酸浸”时所加入的酸是H2SO4 (填化学式).
(3)加入H2O2时发生反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2≤PH<7.1.