题目内容
18.石墨作电极,分别电解 1mol/L 的下列三种电解质溶液一段时间,在电解的过程中,溶 液的 pH 依次为升高、不变和降低的是( )| A. | AgNO3、CuCl2、Cu(NO3)2 | B. | KCl、Na2SO4、CuSO4 | ||
| C. | CaCl2、KOH、NaNO3 | D. | HCl、HNO3、K2SO4 |
分析 用惰性电极电解电解质溶液,阳极的放电顺序:银离子>铜离子>氢离子,阴极离子的放电顺序:氯离子>氢氧根离子,根据两个电极的放电顺序,分析电解后溶液的成分来回答.
解答 解:A、电解AgNO3会生成硝酸、银和氧气,电解CuCl2会生成铜和氯气,电解Cu(NO3)2时会生成铜、硝酸和氧气,溶液的pH依次为降低,不变,降低,故A错误;
B、电解KCl时会生成氢气、氯气单质和氢氧化钾,电解Na2SO4 生成氢气和氧气,即电解水型的,电解CuSO4时,生成铜和氧气以及硫酸,溶液的pH依次为升高,不变,降低,故B正确;
C、电解CaCl2时生成氢氧化钙、氯气和氢气,电解KOH时生成氢气和氧气,即电解水型的,电解NaNO3时,生成氢气和氧气,即电解水型的,溶液的PH依次为升高,升高,不变,故C错误;
D、电解HCl生成氯气和氢气,电解本身,电解HNO3时生成氢气和氧气,即电解水型的,电解K2SO4时,时生成氢气和氧气,即电解水型的,溶液的PH依次为升高,降低,不变,故D错误.
故选B.
点评 本题是对电解原理的考查,要求学生会根据电解原理书写常见电解质的电解反应,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
4.下列说法正确的是( )
| A. | 金属氧化物一定是碱性氧化物 | |
| B. | 胶体和其他分散系的本质区别是分散质粒子大小不同 | |
| C. | 混合物肯定由两种以上元素组成 | |
| D. | 酸性氧化物一定是非金属氧化物 |
3. 下列各组物质中,满足图中所示物质一步转化关系的选项是( )
下列各组物质中,满足图中所示物质一步转化关系的选项是( )
 下列各组物质中,满足图中所示物质一步转化关系的选项是( )
下列各组物质中,满足图中所示物质一步转化关系的选项是( )| 选项 | X | Y | Z |
| A | Na | NaOH | Na2CO3 |
| B | Cu | CuCl2 | Cu(OH)2 |
| C | Mg | MgO | MgCl2 |
| D | Al | Al2O3 | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
10.分子式为C12H24O2有机物A,能在酸性条件下水解生成有机物C和D,且C在一定条件下可转化成D,则A的可能结构有( )
| A. | 4种 | B. | 16种 | C. | 7种 | D. | 49种 |
7.相对分子质量为86的烷烃,有几种同分异构体( )
| A. | 6 | B. | 5 | C. | 4 | D. | 3 |
8.联氨(N2H4)和N2O4可作为火箭推进剂.已知:
①2O2(g)+N2(g)═N2O4(l)△H1
②N2(g)+2H2(g)═N2O4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=-1048.9kJ/mol-1
下列叙述不正确的是( )
①2O2(g)+N2(g)═N2O4(l)△H1
②N2(g)+2H2(g)═N2O4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=-1048.9kJ/mol-1
下列叙述不正确的是( )
| A. | △H3不是H2(g)的燃烧热 | |
| B. | △H4=2△H 3-2△H2-△H1 | |
| C. | 联氨和N2O4反应放热多、产生大量气体,因此可作为火箭推进剂 | |
| D. | 若联氨为气态,△H4大于-1048.9kJ?mol-1 |


 、
、 、
、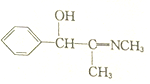
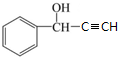 ,其核磁共振氢谱显示为6组峰,峰面积之比为1:2:2:1:1:1.
,其核磁共振氢谱显示为6组峰,峰面积之比为1:2:2:1:1:1.
 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$
 的路线(无机试剂任选):
的路线(无机试剂任选): .
.