题目内容
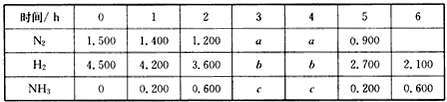
A.移走了氨气 B.降低温度 C.加压 D.增加氢气浓度 E.升高温度 F.增加氮气浓度
(3)将NH3通入到0.04 mol/L的FeCl3溶液中,要使溶液中Fe3+沉淀较完全(即Fe3+浓度降至原来的千分之一),则溶液的pH为_______[已知常温下,Fe(OH)3的溶度积常数Ksp=4×10-38]

(2)A;BF
(3)3

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案制取尿素 [CO(NH2)2]的反应:2NH3(g)+CO2(g) 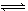 CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
某温度下体积为10L的密闭容器中,测得各物质的物质的量数据如下:
|
物质的量mol |
0min |
2 min |
3 min |
4 min |
|
NH3 |
2.0 |
1.4 |
n1 |
n1 |
|
CO2 |
1.0 |
0.7 |
n2 |
n2 |
|
H2O |
0 |
0.3 |
n3[ |
n3 |
(1)根据表中数据计算0~2min内NH3的平均反应速率 ,若起始时与平衡时的气体总压强之比为15/11,n1= mol。
(2)该温度下此反应的平衡常数表达式为
(3)下列各项能表示该反应达到平衡状态是 。
A.消耗NH3的物质的量与生成H2O的物质的量之比为2∶1
B.c(NH3):c(CO2):c(H2O)=2∶1∶1
C.气体密度不再变化
D.容器压强不再变化
合成氨和制备硝酸是两种重要的化工生产,重庆某化工厂将合成氨与制备硝酸进行连续生产。
(1)在某温度下体积为200 L的氨合成塔中,以分为单位的时间点上测得各物质的浓度(mol·L﹣1)如下表:
|
|
0 min |
l min |
2 min |
3 min |
4 min |
|
N2 |
1.500 |
1.400 |
1.200 |
c1 |
c1 |
|
H2 |
4.500 |
4.200 |
3.600 |
c2 |
c2 |
|
NH3 |
0 |
0.200 |
0.600 |
c3 |
c3 |
根据表中数据得知0 min~2 min内N2的平均反应速率是_______,若3 min末N2的转化率为a,则此时H2的转化率为_______ (用含a的代数式表示)。
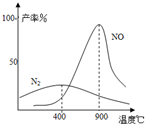
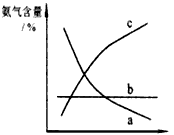
(2)今对合成氨反应进行如下研究:在容积均为10 L的a、b、c三个相同密闭容器中分别充入1 mol N2和3 mol H2,三个容器的反应温度分别为T1、T2、T3,在其他条件相同情况下,实验测得反应均进行到5 min时,NH3的体积分数如图所示。则下列说法正确的是_______。

A.a、b、C三容器5 min时的正反应速率大小为:b>a>c
B.达到平衡时,a、b、c中N2转化率为a>b>c
C.5min时,a、b、c三容器中的反应均可能达到平衡状态。
D.将容器b中的平衡状态转变到容器c中的平衡状态,可采取的措施有升温或减压
(3)已知:N2(g)+O2(g)=2NO(g): △H=+180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=﹣905 kJ/mol
2H2(g)+O2(g)=2H2O(g); △H=﹣483.6 kJ/mol
则在该条件下,氨合成塔中所发生反应的热化学方程式为:____________________________;
(4)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,写出该反应的离子方程式:_________________________________________;
(5)取200 mL的硝酸恰好与32 g Cu2S完全反应,已知硝酸被还原成等物质的量的NO和NO2,另外还有CuSO4和Cu(NO3)2生成,则所得工业硝酸的浓度是_______mol·L﹣1。
 (2009?中山模拟)工业合成氨与制备硝酸一般可连续生产,流程如下:
(2009?中山模拟)工业合成氨与制备硝酸一般可连续生产,流程如下: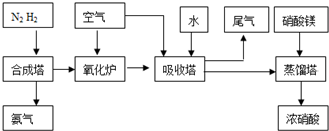
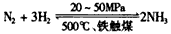 △H <0,生产流程如图所示。
△H <0,生产流程如图所示。 

 N2(g)+3H2(g)的平衡常数______________。
N2(g)+3H2(g)的平衡常数______________。