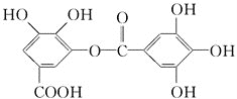
题目内容
【题目】有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W![]() X+H2O+CO2↑
X+H2O+CO2↑
②Z+CO2→X+O2
③Z+H2O→Y+O2↑
④X+Ca(OH)2→Y+CaCO3↓
试回答下列问题:
(1)W、X、Y、Z的化学式分别是W:__、X:__、Y:__、Z__。
(2)以上4个化学反应,属于氧化还原反应的是__(填反应序号),反应中还原剂是__(写化学式)。反应②中每生成标况下3.36L气体,转移电子的数目为__。
【答案】NaHCO3 Na2CO3 NaOH Na2O2 ②③ Na2O2 0.3NA
【解析】
四种钠的化合物,Z能与二氧化碳、水反应生成氧气,故Z为Na2O2,X为Na2CO3,Y为NaOH,W分解生成碳酸钠、二氧化碳与水,故W为NaHCO3,据此解答。
(1)由上述分析可知,W、X、Y、Z的化学式分别是:NaHCO3、Na2CO3、NaOH、Na2O2;
(2)反应①为2NaHCO3![]() Na2CO3+CO2↑+H2O,反应④为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,两反应是非氧化还原反应,反应②为2Na2O2+2CO2=2Na2CO3+O2,反应③为2Na2O2+2H2O=4NaOH+O2↑,两反应是氧化还原反应,反应中Na2O2既是氧化剂又是还原剂;
Na2CO3+CO2↑+H2O,反应④为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,两反应是非氧化还原反应,反应②为2Na2O2+2CO2=2Na2CO3+O2,反应③为2Na2O2+2H2O=4NaOH+O2↑,两反应是氧化还原反应,反应中Na2O2既是氧化剂又是还原剂;
(3)反应②的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,根据方程式可知,若反应生成![]() =0.15molO2,则反应过程中转移的电子数目为0.3NA。
=0.15molO2,则反应过程中转移的电子数目为0.3NA。

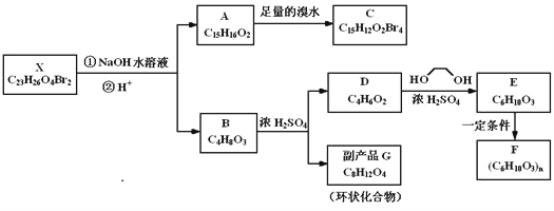
【题目】钒(V)为过渡元素,可形成多价态化合物,在工业催化、新材料、新能源等领域有广泛应用。
(1)金属钒熔点很高,可由铝热反应制得。
已知25℃、101 KPa时
4A1(s)+3O2(g)═2Al2O3(s)△H1=akJmol-1
4V(s)+5O2(g)═2V2O5(s)△H2=bkJmol-1
则用铝热反应冶炼金属V(s)的热化学方程式为______。
(2)全钒液流电池是一种新型的绿色环保储能系统,工作原理如图所示:
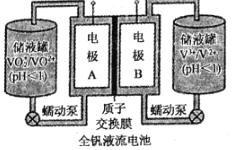
查阅相关资料可知:
离子种类 | VO2+ | VO2+ | V3+ | V2+ |
颜色 | 黄色 | 蓝色 | 绿色 | 紫色 |
①该电池放电时,VO2+发生还原反应,则正极的反应式是______。
②当完成储能时,负极溶液的颜色为______。
③电池放电时,负极区溶液的pH将______(填“增大”、“减小”或“不变”)。
④用该钒电池在铁制品上镀铜,铁制品应与电池的______极(填“A“或“B“)相连。若电镀开始时两电极质量相等,电镀一段时间后,两电极质量之差为128g,此时转移电子的物质的量为______。