题目内容
硫及其化合物在生产和生活中有广泛的应用,接触法制硫酸可以用黄铁矿或硫为原料.完成下列计算:
(1)某化工厂以黄铁矿为原料,用接触法制硫酸.黄铁矿煅烧时FeS2的利用率为90%,SO2的转化率为95%,SO3吸收为H2SO4时的损耗率为2%.现有含70% FeS2的黄铁矿1 吨,可生产98%的硫酸 吨.
(2)某化工厂以硫为原料,为使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后混合气体中含氧气的体积分数为11%.若空气中氧气的体积分数为21%,且不考虑各生产阶段的物料损失.问该厂生产100吨 98%的硫酸需要消耗标准状况下空气 m3.
(3)直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.在钠碱循环法中,若用500mL 0.20mol/LNaOH溶液吸收SO2制得pH=8.2吸收液,吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
忽略溶液体积变化,不考虑其他形态的含硫化合物,试求(结果保留三位有效数字)
①pH=8.2时溶液中Na2SO3 的物质的量浓度?
②该吸收液pH从8.2变化到6.2过程中吸收的SO2在标准状况下的体积约为多少毫升?
(4)现有只含一种含氧酸根的纯净的固体复盐试样,经测定,该固体中含有一种金属元素和四种非金属元素.为进一步确定该固体成分,现将9.64g该固体试样分成两等份后溶于水,一份滴加足量KOH溶液并微热,立即产生红褐色沉淀和能使湿润的红色石蕊试纸变蓝的气体,沉淀经过滤、洗涤、灼烧,质量为0.800g;另一份滴加足量的盐酸酸化的BaCl2溶液,产生的白色沉淀经过滤、洗涤、灼烧,质量为4.66g.通过计算推断该盐的化学式.
(1)某化工厂以黄铁矿为原料,用接触法制硫酸.黄铁矿煅烧时FeS2的利用率为90%,SO2的转化率为95%,SO3吸收为H2SO4时的损耗率为2%.现有含70% FeS2的黄铁矿1 吨,可生产98%的硫酸
(2)某化工厂以硫为原料,为使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后混合气体中含氧气的体积分数为11%.若空气中氧气的体积分数为21%,且不考虑各生产阶段的物料损失.问该厂生产100吨 98%的硫酸需要消耗标准状况下空气
(3)直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.在钠碱循环法中,若用500mL 0.20mol/LNaOH溶液吸收SO2制得pH=8.2吸收液,吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
①pH=8.2时溶液中Na2SO3 的物质的量浓度?
②该吸收液pH从8.2变化到6.2过程中吸收的SO2在标准状况下的体积约为多少毫升?
(4)现有只含一种含氧酸根的纯净的固体复盐试样,经测定,该固体中含有一种金属元素和四种非金属元素.为进一步确定该固体成分,现将9.64g该固体试样分成两等份后溶于水,一份滴加足量KOH溶液并微热,立即产生红褐色沉淀和能使湿润的红色石蕊试纸变蓝的气体,沉淀经过滤、洗涤、灼烧,质量为0.800g;另一份滴加足量的盐酸酸化的BaCl2溶液,产生的白色沉淀经过滤、洗涤、灼烧,质量为4.66g.通过计算推断该盐的化学式.
考点:化学方程式的有关计算,物质的量浓度的相关计算,复杂化学式的确定
专题:计算题
分析:(1)根据S元素守恒,可得关系式为:FeS2~2SO2~2SO3~2H2SO4,把每一步的利用率、转化率、损失率都以FeS2计算,设制得98%的硫酸xt,结合关系式计算;
(2)燃烧发生反应S+O2
SO2,硫燃烧后体积不变,设消耗空气为bmol,则空气中氧气为0.21bmol,硫燃烧后的气体中氧气为0.11bmol,故硫燃烧消耗的氧气为0.21bmol-0.11bmol=0.1bmol,根据S原子守恒可知n(H2SO4)=n(SO2),结合方程式可知硫燃烧消耗的氧气等于二氧化硫的物质的量,再根据V=nVm计算空气的体积;
(3)①根据钠离子守恒n(NaOH)=2n(Na2SO3 )+n(NaHSO3),据此计算n(Na2SO3 ),再根据c=
计算;
②根据①中分析计算pH=6.2时溶液中n(Na2SO3 )、n(NaHSO3),再根据S原子守恒计算稀释的二氧化硫的物质的量,根据V=nVm计算二氧化硫的体积;
(4)一份滴加足量KOH溶液并微热,立即产生红褐色沉淀和能使湿润的红色石蕊试纸变蓝的气体,沉淀为Fe(OH)3、气体为NH3,说明盐中含有Fe3+、NH4+,沉淀经过滤、洗涤、灼烧,得到0.800g为Fe2O3的质量,根据Fe元素守恒n(Fe3+)=2n(Fe2O3);
另一份滴加足量的盐酸酸化的BaCl2溶液,产生的白色沉淀4.66g为BaSO4,说明盐中含有SO42-,根据硫酸根守恒n(SO42-)=n(BaSO4);
根据电荷守恒可知,n(NH4+)=2n(SO42-)-3n(Fe3+);
再根据m=nM计算m(NH4+)、m(Fe3+)、m(SO42-),根据三者质量之和与每份复盐的质量判断是否含有结晶水,若含有结晶水,再计算结晶水的质量,进而计算结晶水的物质的量,计算n(NH4+):n(Fe3+):n(SO42-):n(H2O)确定化学式.
(2)燃烧发生反应S+O2
| ||
(3)①根据钠离子守恒n(NaOH)=2n(Na2SO3 )+n(NaHSO3),据此计算n(Na2SO3 ),再根据c=
| n |
| V |
②根据①中分析计算pH=6.2时溶液中n(Na2SO3 )、n(NaHSO3),再根据S原子守恒计算稀释的二氧化硫的物质的量,根据V=nVm计算二氧化硫的体积;
(4)一份滴加足量KOH溶液并微热,立即产生红褐色沉淀和能使湿润的红色石蕊试纸变蓝的气体,沉淀为Fe(OH)3、气体为NH3,说明盐中含有Fe3+、NH4+,沉淀经过滤、洗涤、灼烧,得到0.800g为Fe2O3的质量,根据Fe元素守恒n(Fe3+)=2n(Fe2O3);
另一份滴加足量的盐酸酸化的BaCl2溶液,产生的白色沉淀4.66g为BaSO4,说明盐中含有SO42-,根据硫酸根守恒n(SO42-)=n(BaSO4);
根据电荷守恒可知,n(NH4+)=2n(SO42-)-3n(Fe3+);
再根据m=nM计算m(NH4+)、m(Fe3+)、m(SO42-),根据三者质量之和与每份复盐的质量判断是否含有结晶水,若含有结晶水,再计算结晶水的质量,进而计算结晶水的物质的量,计算n(NH4+):n(Fe3+):n(SO42-):n(H2O)确定化学式.
解答:
解:(1)设制得98%的硫酸xt,
FeS2~~2SO2~~2SO3~~2H2SO4
120 196
1t×70%×90%×95%×(1-2%) x×98%
x=
=0.978t,
故答案为:0.978;
(2)燃烧发生反应S+O2
SO2,硫燃烧后体积不变,设消耗空气为bmol,则空气中氧气为0.21bmol,硫燃烧后的气体中氧气为0.11bmol,故硫燃烧消耗的氧气为0.21bmol-0.11bmol=0.1bmol,每天生成H2SO4的物质的量=
=1×106mol,根据S原子守恒可知n(H2SO4)=n(SO2)=1×106mol,由方程式可知:1×106mol=0.1bmol,故b=1×107,故需要空气的体积=1×107mol×0.0224m3/L=2.24×105 m3,
故答案为:2.24×105;
(3)①n(NaOH)=0.5L×0.20mol/L=0.1mol,pH=8.2时溶液中n(SO32-):n(HSO3-)=91:9,令n(SO32-)=91a mol、n(HSO3-)=9a mol,根据钠离子守恒,则:91a mol×2+9a mol=0.1 mol,解得a=
,故Na2SO3 的物质的量浓度=
=0.0953mol/L,
答:pH=8.2时溶液中Na2SO3 的物质的量浓度为0.0953mol/L.
②pH=6.2时溶液中n(SO32-):n(HSO3-)=9:91,令n(SO32-)=9b mol、n(HSO3-)=91b mol,根据钠离子守恒,则:9b mol×2+91b mol=0.1 mol,解得b=
,
根据S原子守恒可知,吸收的SO2为:100b-100a=100×(
-
),故标况下吸收SO2的体积为:100×(
-
)×22400mL/mol=883mL,
答:吸收的SO2在标准状况下的体积约为883mL.
(4)一份滴加足量KOH溶液并微热,立即产生红褐色沉淀和能使湿润的红色石蕊试纸变蓝的气体,沉淀为Fe(OH)3、气体为NH3,说明盐中含有Fe3+、NH4+,沉淀经过滤、洗涤、灼烧,得到0.800g为Fe2O3的质量,根据Fe元素守恒n(Fe3+)=2n(Fe2O3)=
=0.01mol;
另一份滴加足量的盐酸酸化的BaCl2溶液,产生的白色沉淀4.66g为BaSO4,说明盐中含有SO42-,根据硫酸根守恒n(SO42-)=n(BaSO4)=
=0.02mol,
根据电荷守恒可知,n(NH4+)=2n(SO42-)-3n(Fe3+)=2×0.02mol-3×0.01mol=0.01mol,
故m(NH4+)+m(Fe3+)+m(SO42-)=0.01mol×18g/mol+0.01mol×56g/mol+0.02mol×96g/mol=2.66g,每份盐的质量=
=4.82g>2.66g,该固体中含有一种金属元素和四种非金属元素,故还含有结晶水,则结晶水的质量=4.82g-2.66g=2.16g,其物质的量=
=0.12mol,
故该复盐中n(NH4+):n(Fe3+):n(SO42-):n(H2O)=0.01:0.01:0.02:0.12=1:1:2:12,
故该复盐的化学式为:NH4Fe(SO4)2?12H2O,
答:该复盐的化学式为NH4Fe(SO4)2?12H2O.
FeS2~~2SO2~~2SO3~~2H2SO4
120 196
1t×70%×90%×95%×(1-2%) x×98%
x=
| 1t×70%×90%×95%×(1-2%)×196 |
| 120×98% |
故答案为:0.978;
(2)燃烧发生反应S+O2
| ||
| 100×106g×98% |
| 98g/mol |
故答案为:2.24×105;
(3)①n(NaOH)=0.5L×0.20mol/L=0.1mol,pH=8.2时溶液中n(SO32-):n(HSO3-)=91:9,令n(SO32-)=91a mol、n(HSO3-)=9a mol,根据钠离子守恒,则:91a mol×2+9a mol=0.1 mol,解得a=
| 0.1 |
| 191 |
| ||
| 0.5L |
答:pH=8.2时溶液中Na2SO3 的物质的量浓度为0.0953mol/L.
②pH=6.2时溶液中n(SO32-):n(HSO3-)=9:91,令n(SO32-)=9b mol、n(HSO3-)=91b mol,根据钠离子守恒,则:9b mol×2+91b mol=0.1 mol,解得b=
| 0.1 |
| 109 |
根据S原子守恒可知,吸收的SO2为:100b-100a=100×(
| 0.1mol |
| 109 |
| 0.1mol |
| 191 |
| 0.1mol |
| 109 |
| 0.1mol |
| 191 |
答:吸收的SO2在标准状况下的体积约为883mL.
(4)一份滴加足量KOH溶液并微热,立即产生红褐色沉淀和能使湿润的红色石蕊试纸变蓝的气体,沉淀为Fe(OH)3、气体为NH3,说明盐中含有Fe3+、NH4+,沉淀经过滤、洗涤、灼烧,得到0.800g为Fe2O3的质量,根据Fe元素守恒n(Fe3+)=2n(Fe2O3)=
| 0.8g |
| 160g/mol |
另一份滴加足量的盐酸酸化的BaCl2溶液,产生的白色沉淀4.66g为BaSO4,说明盐中含有SO42-,根据硫酸根守恒n(SO42-)=n(BaSO4)=
| 4.66g |
| 233g/mol |
根据电荷守恒可知,n(NH4+)=2n(SO42-)-3n(Fe3+)=2×0.02mol-3×0.01mol=0.01mol,
故m(NH4+)+m(Fe3+)+m(SO42-)=0.01mol×18g/mol+0.01mol×56g/mol+0.02mol×96g/mol=2.66g,每份盐的质量=
| 9.64g |
| 2 |
| 2.16g |
| 18g/mol |
故该复盐中n(NH4+):n(Fe3+):n(SO42-):n(H2O)=0.01:0.01:0.02:0.12=1:1:2:12,
故该复盐的化学式为:NH4Fe(SO4)2?12H2O,
答:该复盐的化学式为NH4Fe(SO4)2?12H2O.
点评:本题考查多步反应计算、化学方程式计算、混合物计算、无机物推断等,属于拼合型题目,是对学生综合能力的考查,难度较大.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
实验设计是化学实验的重要技能之一.用所给装置(夹持装置省略)完成相关实验,最合理的选项是( )
A、 利用图除去乙烷中的乙烯 |
B、 利用图比较单质S、Cl2的氧化性 |
C、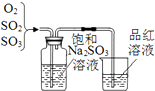 利用图检验硫酸铜晶体受热分解气体中的二氧化硫 |
D、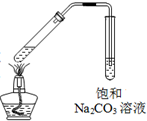 利用图实验室加热浓硫酸、乙醇和乙酸制取乙酸乙酯 |
鉴别甲苯、苯酚溶液、已烯、碘化钾淀粉溶液、硝酸银溶液等五种无色液体的一种试剂是( )
| A、KMnO4酸性溶液 |
| B、FeCl3溶液 |
| C、溴水 |
| D、金属钠 |
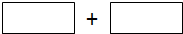
 )为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
)为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
 )为起始物质,通过加成、消去反应制得.写出由苯乙烯制取苯乙炔的化学方程式(所需的无机试剂自选)
)为起始物质,通过加成、消去反应制得.写出由苯乙烯制取苯乙炔的化学方程式(所需的无机试剂自选)