题目内容
14.短周期元素的离子aXm+、bYn+、cZn-和dWm-具有相同的电子层结构,若m>n,下列叙述正确的是( )①元素的原子序数:a>b>c>d
②a-b=n-m
③原子半径:X>Y>Z>W
④离子半径:Yn+>Xm+>Wm->Zn-
⑤简单阴离子的还原性:W>Z.
| A. | ①⑤ | B. | ①②③ | C. | ①③④⑤ | D. | ②③④⑤ |
分析 四种主族元素的离子aXm+、bYn+、cZn-和dWm-具有相同的电子层结构,则a-m=b-n=c+n=d+m,若m>n,则原子序数大小顺序是:a>b>c>d,结合离子所得电荷可知,X、Y为金属元素,Z、R为非金属元素,且X、Y位于Z和R的下一周期.在同一周期元素中随着原子序数的增大,元素的非金属性增强、金属性减弱,而元素的金属性越强,其最高价氧化物的水化物碱性越强.而电子层结构相同的离子,核电荷数越大离子半径越小,以此解答该题.
解答 解:①由上述分析可知,元素的原子序数为a>b>c>d,故正确;
②由a-m=b-n可知,a-b=n+m,故错误;
③原子序数大小顺序是:a>b,X、Y位于同一周期,则原子半径:X<Y,故错误;
④核电荷数越大离子半径越小,则离子半径:Wm->Zn->Yn+>Xm+,故错误;
⑤非金属性Z>W,简单阴离子的还原性:W>Z,故正确.
故选A.
点评 本题考查结构性质位置关系元素,为高频考点,侧重考查学生的分析能力,关键明确元素在周期表中的相对位置,注意对元素周期律的理解掌握,难度中等.

练习册系列答案
相关题目
5.将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).判断该分解反应已经达到化学平衡状态的是( )
| A. | 2v(NH3)=v (CO2) | |
| B. | 密闭容器中气体的平均摩尔质量不变 | |
| C. | 密闭容器中混合气体的密度不变 | |
| D. | 密闭容器中氨气的体积分数不变 |
5.S(单斜)和S(正交)是硫的两种同素异形体.已知:
①S(s,单斜)+O2(g)═SO2(g)△H1=-297.16kJ•mol-1
②S(s,正交)+O2(g)═SO2(g)△H2=-296.83kJ•mol-1
③S(s,单斜)═S(s,正交)△H3.
下列说法正确的是( )
①S(s,单斜)+O2(g)═SO2(g)△H1=-297.16kJ•mol-1
②S(s,正交)+O2(g)═SO2(g)△H2=-296.83kJ•mol-1
③S(s,单斜)═S(s,正交)△H3.
下列说法正确的是( )
| A. | S(s,单斜)═S(s,正交)△H3<0,正交硫比单斜硫稳定 | |
| B. | 单斜硫转化为正交硫的反应是吸热反应 | |
| C. | △H3=+0.33 kJ•mol-1 | |
| D. | S(s,单斜)═S(s,正交)△H3>0,单斜硫比正交硫稳定 |
2.下图为氢气燃烧生成水蒸气的化学键变化与吸收、释放能量关系.下列关系式中正确的是( )

| A. | 2Q1+Q2>4Q3 | B. | 2Q1+Q2<4Q3 | C. | Q1+Q2>4Q3 | D. | Q1+$\frac{1}{2}$Q2=2Q3 |
19.下列物质中,含有共价键的离子化合物是( )
| A. | Na2O | B. | Na2O2 | C. | MgCl2 | D. | H2S |
3.下列有关实验现象的描述不正确的是( )
| A. | 将表面变暗的金属钠粒投入干燥氯气中,无明显现象 | |
| B. | 将在空气中点燃的金属钠伸入干燥氯气中会继续燃烧,产生黄色火焰和大量黄烟 | |
| C. | 将SO2气体通入溴水中使溴水褪色,滴加BaCl2溶液有白色沉淀产生 | |
| D. | SO2气体通入品红溶液中,品红褪色,加热所得无色溶液红色复原 |
6.食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于3.5g/100mL.用中和滴定的方法可以测定食醋中醋酸的浓度,某白醋的醋酸浓度测定过程如图所示:
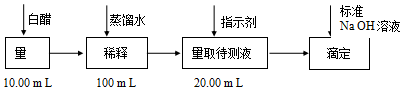
完成下列填空:
(1)稀释白醋时需要的仪器有烧杯、玻璃棒、胶头滴管、100mL容量瓶.
(2)应选用酚酞作为指示剂.达到滴定终点时,指示剂从无色变为浅红色.
(3)某同学一共进行了三次实验.以下是他设计的实验数据记录表,表格中A是滴定前读数,B是滴定后读数.
数据处理:消耗标准NaOH溶液的体积=21.32mL.
若测得稀释后白醋的浓度0.0594mol/L,则该食醋符合(选填“符合”、“不符合”)国家标准.
标准NaOH溶液通过以下步骤准备:①配制500mL浓度约为0.1mol/L的NaOH溶液;
②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度.
(4)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解,该配制步骤可行可行
(填“可行”或“不可行”).
(5)NaOH标准溶液的浓度需通过测定而不能直接配制的原因是NaOH固体在称量时容易吸收空气中的水和CO2,使配制所得的溶液浓度低于预期浓度,导致实验误差.

完成下列填空:
(1)稀释白醋时需要的仪器有烧杯、玻璃棒、胶头滴管、100mL容量瓶.
(2)应选用酚酞作为指示剂.达到滴定终点时,指示剂从无色变为浅红色.
(3)某同学一共进行了三次实验.以下是他设计的实验数据记录表,表格中A是滴定前读数,B是滴定后读数.
| 实验次数 | 稀释后白醋 体积(mL) | 标准NaOH溶液 | ||
| A | B | 消耗体积(mL) | ||
| 1 | 20.00 | 22.05 | ||
| 2 | 20.00 | 21.34 | ||
| 3 | 20.00 | 21.30 | ||
若测得稀释后白醋的浓度0.0594mol/L,则该食醋符合(选填“符合”、“不符合”)国家标准.
标准NaOH溶液通过以下步骤准备:①配制500mL浓度约为0.1mol/L的NaOH溶液;
②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度.
(4)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解,该配制步骤可行可行
(填“可行”或“不可行”).
(5)NaOH标准溶液的浓度需通过测定而不能直接配制的原因是NaOH固体在称量时容易吸收空气中的水和CO2,使配制所得的溶液浓度低于预期浓度,导致实验误差.

