题目内容
(1)①实验室制备氨气,下列方法中适宜选用的是A.固态氯化铵加热分解
B.氢氧化钠溶液中滴加稀氨水
C.氯化铵溶液与氢氧化钠溶液共热
D.固态氯化铵与氢氧化钙混合加热
②检验氨气是否已经收集满的方法是
③为了得到干燥的NH3,用
A、碱石灰 B、浓H2SO4 C、无水CaCl2 D、P2O5
(2)为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器(内含物质)组装成实验装置.

①如按气流由左向右流向,连接上述装置(各装置只用一次)的正确顺序是(填各接口字母):A-
②什么样的实验现象才表明已检验出CO2?
③写出甲中反应的化学方程式
分析:(1)①氯化铵加热生成氨气和氯化氢,氯化氢和氨气反应生成氯化铵;氨气易溶于水,稀氨水浓度小,不能制氨气;氯化铵溶液与氢氧化钠溶液共热,能制得氨气但量少,不是实验室制备氨气的方法;实验室用固态氯化铵与氢氧化钙混合加热制备氨气;
②氨水显碱性,可使湿润的红色湿润石蕊试纸变蓝;浓盐酸挥发出的HCl气体与氨气反应生成氯化铵白色固体;运用以上两点可检验氨气是否已经收集满;
③氨气为碱性的气体,所以干燥氨气的物质应为碱性或中性;
(2)①根据实验室浓H2SO4氧化木炭的反应原理、条件,固液加热下反应,进行选择发生和验证产物装置;
②根据二氧化碳和二氧化硫的性质进行解答;
③浓硫酸与碳反应生成二氧化碳和二氧化硫和水;
②氨水显碱性,可使湿润的红色湿润石蕊试纸变蓝;浓盐酸挥发出的HCl气体与氨气反应生成氯化铵白色固体;运用以上两点可检验氨气是否已经收集满;
③氨气为碱性的气体,所以干燥氨气的物质应为碱性或中性;
(2)①根据实验室浓H2SO4氧化木炭的反应原理、条件,固液加热下反应,进行选择发生和验证产物装置;
②根据二氧化碳和二氧化硫的性质进行解答;
③浓硫酸与碳反应生成二氧化碳和二氧化硫和水;
解答:解:(1)①A.固态氯化铵加热分解NH4Cl
NH3↑+HCl,NH3+HCl=NH4Cl,故A错误;
B.氨气易溶于水,不能用溶液制备氨气,故B错误;
C.氯化铵溶液与氢氧化钠溶液共热,能制得氨气但量少,不是实验室制备氨气的方法,故C错误;
D.固态氯化铵与氢氧化钙混合加热2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O易制得氨气,是实验室制备氨气的常用方法,故D正确;
故选D;
②氨水显碱性,将用水润湿的红色石蕊试纸放在氨水的试剂瓶口,如收集满,则试纸呈蓝色;NH3和HCl反应生成NH4Cl产生白烟,化学方程式为:NH3+HCl=NH4Cl,用玻璃棒一端蘸取浓盐酸,接近瓶口,产生大量白烟能证明已收集满,
故答案为:湿润的红色湿润石蕊试纸或玻璃棒蘸浓盐酸靠近集气瓶口;
③A、碱石灰显碱性,不与氨气反应,可用于干燥氨气,故A正确;
B、浓H2SO4显酸性,与氨气反应,不可用于干燥氨气,故B错误;
C、无水CaCl2和氨气反应生成络合物,不能干燥氨气,故C错误;
D、P2O5和水反应生成磷酸可以吸收氨气,不能干燥氨气,故D错误;
故选A;
(2)①根据实验室浓H2SO4氧化木炭的反应原理、条件,固液加热下反应,进行选择发生装置,高锰酸钾可氧化二氧化硫,用高锰酸钾酸性溶液除SO2,再通过品红溶液不褪色确认SO2已除干净,验证木炭可被浓H2SO4氧化成CO2,可通过二氧化碳能使澄清的石灰水变浑浊确认,
故答案为:AFECDB;
②乙中为澄清的石灰水,澄清的石灰水和二氧化碳,二氧化硫都反应变浑浊,二氧化硫具有漂白性,二氧化硫能使丙中品红褪色,所以丁装置用高锰酸钾酸性溶液除SO2,再通过品红溶液不褪色,丙中的品红未褪色,乙中溶液变浑浊,表明已检验出CO2,
故答案为:丙中的品红未褪色,乙中溶液变浑浊;
③浓硫酸与碳反应发生氧化还原反应,生成二氧化碳和二氧化硫和水,碳和稀硫酸不反应,
故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;
| ||
B.氨气易溶于水,不能用溶液制备氨气,故B错误;
C.氯化铵溶液与氢氧化钠溶液共热,能制得氨气但量少,不是实验室制备氨气的方法,故C错误;
D.固态氯化铵与氢氧化钙混合加热2NH4Cl+Ca(OH)2
| ||
故选D;
②氨水显碱性,将用水润湿的红色石蕊试纸放在氨水的试剂瓶口,如收集满,则试纸呈蓝色;NH3和HCl反应生成NH4Cl产生白烟,化学方程式为:NH3+HCl=NH4Cl,用玻璃棒一端蘸取浓盐酸,接近瓶口,产生大量白烟能证明已收集满,
故答案为:湿润的红色湿润石蕊试纸或玻璃棒蘸浓盐酸靠近集气瓶口;
③A、碱石灰显碱性,不与氨气反应,可用于干燥氨气,故A正确;
B、浓H2SO4显酸性,与氨气反应,不可用于干燥氨气,故B错误;
C、无水CaCl2和氨气反应生成络合物,不能干燥氨气,故C错误;
D、P2O5和水反应生成磷酸可以吸收氨气,不能干燥氨气,故D错误;
故选A;
(2)①根据实验室浓H2SO4氧化木炭的反应原理、条件,固液加热下反应,进行选择发生装置,高锰酸钾可氧化二氧化硫,用高锰酸钾酸性溶液除SO2,再通过品红溶液不褪色确认SO2已除干净,验证木炭可被浓H2SO4氧化成CO2,可通过二氧化碳能使澄清的石灰水变浑浊确认,
故答案为:AFECDB;
②乙中为澄清的石灰水,澄清的石灰水和二氧化碳,二氧化硫都反应变浑浊,二氧化硫具有漂白性,二氧化硫能使丙中品红褪色,所以丁装置用高锰酸钾酸性溶液除SO2,再通过品红溶液不褪色,丙中的品红未褪色,乙中溶液变浑浊,表明已检验出CO2,
故答案为:丙中的品红未褪色,乙中溶液变浑浊;
③浓硫酸与碳反应发生氧化还原反应,生成二氧化碳和二氧化硫和水,碳和稀硫酸不反应,
故答案为:C+2H2SO4(浓)
| ||
点评:实验室氨气的制备装置和浓硫酸的性质应用,掌握氨气的制备和性质以及掌握二氧化硫的性质是解答的关键,题目难度中等.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
 合成氨工业对化学和国防工业具有重要意义.
合成氨工业对化学和国防工业具有重要意义.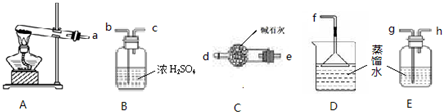
 某课外小组在实验室制备氨气,并进行有关氨气的性质探究.
某课外小组在实验室制备氨气,并进行有关氨气的性质探究. 某化学实验小组同学利用如图1装置制备氨气,并探究氨气的性质(部分仪器已略去).
某化学实验小组同学利用如图1装置制备氨气,并探究氨气的性质(部分仪器已略去). 乙:
乙: .
.