题目内容
 某课外小组在实验室制备氨气,并进行有关氨气的性质探究.
某课外小组在实验室制备氨气,并进行有关氨气的性质探究.(1)该小组同学设计下图所示装置探究氨气的还原性.
①氨催化氧化的化学方程式为
②若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为
(2)该小组同学以氨气和二氧化碳为原料制备碳酸氢铵.
①甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳.请选择合理的方案并说明原因:
②检验产物中有NH4+的方法为
分析:(1)①在一定条件下氨气与氧气反应生成一氧化氮和水;②氨气和硝酸反应生成硝酸铵固体产生白烟;
(2))①根据氨气和二氧化碳在水中的溶解性分析对产物的影响,以此评价方案;
②检验NH4+离子时,加入碱在加热条件下反应生成氨气,氨气水溶液呈碱性,可使湿润的红色石蕊试纸变蓝.
(2))①根据氨气和二氧化碳在水中的溶解性分析对产物的影响,以此评价方案;
②检验NH4+离子时,加入碱在加热条件下反应生成氨气,氨气水溶液呈碱性,可使湿润的红色石蕊试纸变蓝.
解答:解:(1)①氨催化氧化的产物是一氧化氮和水,是工业生产硝酸获得一氧化氮的一步反应,化学方程式为4NH3+5O2
4NO+6H2O,
故答案为:4NH3+5O2
4NO+6H2O;
②氨气被氧化为NO和水,进而与氧气反应生成硝酸,如通入氨气过快,则生成NH4NO3,产生白烟,
故答案为:NH4NO3;
(2))①二氧化碳微溶于水,先通入二氧化碳,溶液中生成极少量的碳酸,再通入氨气,生成的产物量少,且易生成碳酸铵,氨气在水中溶解度很大,先通入氨气,溶液中生成较多的一水合氨,再通入CO2,生成的产物量多,且易生成碳酸氢铵,故乙方案正确,
故答案为:乙正确,因二氧化碳在水中溶解度较小,先通入二氧化碳,再通入氨气,生成的产物量少,且易生成碳酸铵; 氨气在水中溶解度很大,先通入氨气,再通入CO2,生成的产物量多,且易生成碳酸氢铵;
②检验NH4+离子时,加入碱在加热条件下反应生成氨气,氨气水溶液呈碱性,可使湿润的红色石蕊试纸变蓝,
故答案为:取少量产物放入试管中,加入浓NaOH溶液,加热,在试管口放置湿润的红色石蕊试纸,若试纸变蓝,则证明产物中有NH4+.
| ||
| 高温高压 |
故答案为:4NH3+5O2
| ||
| 高温高压 |
②氨气被氧化为NO和水,进而与氧气反应生成硝酸,如通入氨气过快,则生成NH4NO3,产生白烟,
故答案为:NH4NO3;
(2))①二氧化碳微溶于水,先通入二氧化碳,溶液中生成极少量的碳酸,再通入氨气,生成的产物量少,且易生成碳酸铵,氨气在水中溶解度很大,先通入氨气,溶液中生成较多的一水合氨,再通入CO2,生成的产物量多,且易生成碳酸氢铵,故乙方案正确,
故答案为:乙正确,因二氧化碳在水中溶解度较小,先通入二氧化碳,再通入氨气,生成的产物量少,且易生成碳酸铵; 氨气在水中溶解度很大,先通入氨气,再通入CO2,生成的产物量多,且易生成碳酸氢铵;
②检验NH4+离子时,加入碱在加热条件下反应生成氨气,氨气水溶液呈碱性,可使湿润的红色石蕊试纸变蓝,
故答案为:取少量产物放入试管中,加入浓NaOH溶液,加热,在试管口放置湿润的红色石蕊试纸,若试纸变蓝,则证明产物中有NH4+.
点评:本题考查了氨气的实验室制备和实验方案的评价等问题,注意气体的制备方案的设计的合理性,题目难度不大.

练习册系列答案
相关题目
海洋约占地球表面积的71%,海水化学资源的利用具有非常广阔的前景。
(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、 、 可制得精盐。
(2)镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的,其主要步骤如下:
①为了使MgSO4转化为Mg(OH) 2,试剂①可以选用 ,要使MgSO4完全转化为沉淀,加入试剂①的量应 ;
②试剂②可以选用 ;
③试从节约能源、提高金属镁的纯度分析,以下适宜的冶镁方法是 。
A. | B.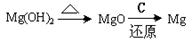 |
C. | D. |
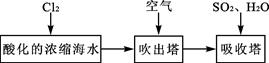
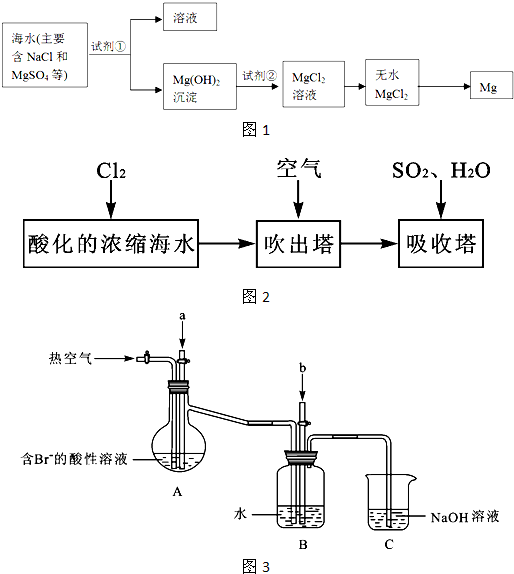
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):

①A装置中通入a气体的目的是(用离子方程式表示) ;
②A装置中通入a气体一段时间后,停止通入,改通热空气。通入热空气的目的是
;
③反应过程中,B装置中有SO42-生成。检验SO42-的方法是 ;
④C装置的作用是 。





 B.
B.
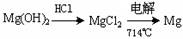 D.
D.

