题目内容
在下列溶液中,各组离子一定能够大量共存的是( )
| A、加入铝粉能放出氢气的溶液:Na+、Cl-、SO42-、Fe3+ |
| B、使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
| C、c(OH-)=10-12 mol?L-1的溶液:K+、Ba2+、Cl-、Br- |
| D、在含有大量AlO2-的溶液中:NH4+、Na+、Cl-、H+ |
考点:离子共存问题
专题:离子反应专题
分析:A.加入铝粉能放出氢气的溶液为酸性或者碱性溶液,铁离子能够与氢氧根离子反应生成氢氧化铁沉淀;
B.使紫色石蕊试液变红的溶液为酸性溶液,硝酸根离子在酸性条件下能够氧化亚铁离子;
C.c(OH-)=10-12 mol?L-1的溶液为酸性溶液,K+、Ba2+、Cl-、Br-离子之间不发生反应,也不与氢离子反应;
D.含有大量AlO2-的溶液中,铵根离子、氢离子能够与偏铝酸根发生反应.
B.使紫色石蕊试液变红的溶液为酸性溶液,硝酸根离子在酸性条件下能够氧化亚铁离子;
C.c(OH-)=10-12 mol?L-1的溶液为酸性溶液,K+、Ba2+、Cl-、Br-离子之间不发生反应,也不与氢离子反应;
D.含有大量AlO2-的溶液中,铵根离子、氢离子能够与偏铝酸根发生反应.
解答:
解:A.加入铝粉能放出氢气的溶液中存在大量的H+或OH-,Fe3+离子与OH-发生反应,在溶液中不能大量共存,故A错误;
B.使紫色石蕊试液变红的溶液中存在大量H+,NO3-在酸性溶液中具有强氧化性,能够氧化Fe2+离子,在溶液中不能大量共存,故B错误;
C.c(OH-)=10-12 mol?L-1的溶液为酸性溶液,K+、Ba2+、Cl-、Br-离子之间不反应,且都不与氢离子反应,在溶液中能够大量共存,故C正确;
D.AlO2- 与NH4+、H+离子发生反应,在溶液中不能大量共存,故D错误;
故选C.
B.使紫色石蕊试液变红的溶液中存在大量H+,NO3-在酸性溶液中具有强氧化性,能够氧化Fe2+离子,在溶液中不能大量共存,故B错误;
C.c(OH-)=10-12 mol?L-1的溶液为酸性溶液,K+、Ba2+、Cl-、Br-离子之间不反应,且都不与氢离子反应,在溶液中能够大量共存,故C正确;
D.AlO2- 与NH4+、H+离子发生反应,在溶液中不能大量共存,故D错误;
故选C.
点评:本题考查离子共存的正误判断,为高考中的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等.

练习册系列答案
相关题目
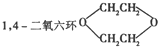 是一种常见的溶剂,它可以通过以下方法制得:A(烃类)
是一种常见的溶剂,它可以通过以下方法制得:A(烃类)| Br2 |
| N2OH/水 |
| 浓H2SO4 |
| △脱水 |
| A、丁烯 | B、丁炔 | C、乙炔 | D、乙烯 |
下列结论正确的是( )
| A、酸碱中和反应能生成盐和水,所以生成盐和水的反应一定是中和反应 |
| B、饱和溶液降低温度一定会析出晶体 |
| C、组成元素相同的物质化学性质不一定相同 |
| D、质子数相同的两种粒子其核外电子数一定相等 |
下列有关物质分类或归类正确的是( )
| A、混合物:石炭酸、福尔马林、水玻璃、水银 |
| B、化合物:CaCl2、烧碱、聚苯乙烯、HD |
| C、同系物:CH2O2、C2H4O2、C3H4O2、C4H8O2 |
| D、同素异形体:C60、C70、金刚石、石墨 |
新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化.某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下,下列说法正确的是( )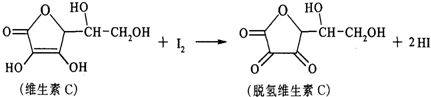

| A、上述反应为取代反应 |
| B、维生素C能抗衰老是因为有氧化性 |
| C、滴定时可用淀粉溶液作指示剂 |
| D、维生素C能发生银镜反应 |
下列关于平衡常数的说法中,正确的是( )
| A、在平衡常数表达式中,反应物浓度用初始浓度,生成物浓度用平衡浓度 |
| B、在任何条件下,化学平衡常数是一个恒定值 |
| C、平衡常数的大小只与浓度有关,而与温度、压强、催化剂等无关 |
| D、从平衡常数的大小可以推断一个反应进行的程度 |
 由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如图所示(某些产物已略去):
由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如图所示(某些产物已略去):