题目内容
用a、b两个惰性电极电解0.2L一定浓度的CuSO4溶液用a极上产生的4.48L(标准状况下)气体时,b极上只有固体析出.然后将电源反接,继续通直流电,当b极上产生4.48L(标准状况下)气体时溶液质量共减少45.4g.则原来CuSO4的物质的量浓度为( )
| A、1.0mol/L |
| B、2.5mol/L |
| C、1.5mol/L |
| D、1.8mol/L |
考点:电解原理
专题:电化学专题
分析:用惰性电极电解电解硫酸铜溶液时的总的电极反应为:2Cu2++2H2O
2Cu+O2↑+4H+,n(O2)=
=0.2mol,所以n(Cu)=2n(O2)=0.4mol,电源反接b为阳极,首先是0.4mol的铜放电,然后是氢氧根离子放电产生氧气0.2mol,而a极首先是溶液中铜离子放电,后来是氢离子放电,根据溶液质量共减少45.4g,综合分析解题.
| ||
| 4.48L |
| 22.4L/mol |
解答:
解:首先a电极产生过4.48L气体,即0.2mol氧气,溶液质量减轻6.4g; 反接之后,b电极析出的铜溶解,A电极析出铜,当b电极铜完全溶解后,a电极的铜析出量与b电极溶解量相同.此阶段溶液质量不变. 当B电极产生气体时,A电极会先析出溶液中剩余的铜,然后产生氢气.B电极产生4.48L气体,即0.2mol氧气,溶液质量减轻6.4g,此时用45.4g减去两次产生氧气的量后,剩余的32.6g是产生铜和析出氢气的总质量.整个过程有1.6mol电子转移,设剩余的铜xmol,产生氢气ymol,根据电子守恒有:2xmol+2ymol=1.6mol,根据质量守恒:64xg+2yg=32.6g,计算出x=0.5,y=0.3,也就是有0.5mol铜析出,根据铜元素守恒,即硫酸铜0.5mol,浓度为0.5mol/0.2L=2.5mol/L,即硫酸铜物质的量浓度为2.5mol/L,
故选B.
故选B.
点评:本题考查电解的原理,电源反接后,原来的阳极是变成阴极,阴极变成阳极,然后根据质量差综合分析解题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
科学家对物质性质的推断一般要基于一些实验事实.下列能说明苯与一般的烯烃性质不同的事实是( )
①苯分子是高度对称的平面型分子 ②苯不与溴水反应 ③苯不与酸性KMnO4溶液发生反应 ④1mol苯在一定条件下可与3molH2进行加成反应.
①苯分子是高度对称的平面型分子 ②苯不与溴水反应 ③苯不与酸性KMnO4溶液发生反应 ④1mol苯在一定条件下可与3molH2进行加成反应.
| A、②③ | B、①②③ |
| C、①③④ | D、全部 |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、1L 1.0mol?L-1的NaC1O溶液中含有C1O-的数目为NA |
| B、标准状况下,22.4L盐酸含有NA个HC1分子 |
| C、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA |
| D、1molNa被完成氧化生成Na2O2,失去个2NA电子 |
在同浓度的KHCO3和NH4HCO3溶液中,c(CO32-)和c(HCO3-)大的分别是( )
| A、KHCO3、NH4HCO3 |
| B、NH4HCO3、KHCO3 |
| C、KHCO3、KHCO3 |
| D、NH4HCO3、NH4HCO3 |
NA表示阿伏加德罗常数的值,4℃时,25滴水为amL,则1滴水中含有的水分子数为( )
| A、aNA/25 |
| B、aNA/(25×18) |
| C、aNA/(25×20) |
| D、aNA/(1000×22.4) |
标准状态下,气态分子断开1mol化学键的焓变为键焓.已知H-H,H-O和O=O键的键焓△H分别为436kJ?mol-1、463kJ?mol-1和495kJ?mol-1.下列热化学方程式正确的是( )
A、H2O(g)═H2(g)+
| ||
B、H2O(g)═H2(g)+
| ||
| C、2H2(g)+O2(g)═2H2O(g)△H=+485kJ?mol-1 | ||
| D、2H2(g)+O2(g)═2H2O(g)△H=-485kJ?mol-1 |
 氨是最重要的化工产品之一.
氨是最重要的化工产品之一.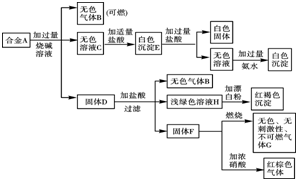 现有四种单质组成的合金A,为分析其成分,用此合金进行一系列实验,其过程及发生反应的现象如下图所示.
现有四种单质组成的合金A,为分析其成分,用此合金进行一系列实验,其过程及发生反应的现象如下图所示.