题目内容
镁铝合金10.2g与足量稀硫酸作用,在标准状态下H211.2L,求原合金中镁和铝的质量?
考点:化学方程式的有关计算,有关混合物反应的计算
专题:计算题
分析:发生反应:Mg+H2SO4=MgSO4+H2↑、2Al+2H2SO4=Al2(SO4)3+3H2↑,设Mg的物质的量为xmol,Al的物质的量为ymol,表示出各自生成氢气的物质的量,再根据二者质量与体积列方程解答.
解答:
解:设Mg的物质的量为x,Al的物质的量为y,有:
Mg+H2SO4=MgSO4+H2↑
1mol 1mol
xmol xmol
2Al+2H2SO4=Al2(SO4)3+3H2↑
2mol 3mol
ymol 1.5ymol
由题意可知:
解得x=0.2 y=0.2
故m(Mg)=0.2mol×24g/mol=4.8g
m(Al)=0.2mol×27g/mol=5.4g
答:原合金中镁的质量为4.8g、铝的质量为5.4g.
Mg+H2SO4=MgSO4+H2↑
1mol 1mol
xmol xmol
2Al+2H2SO4=Al2(SO4)3+3H2↑
2mol 3mol
ymol 1.5ymol
由题意可知:
|
解得x=0.2 y=0.2
故m(Mg)=0.2mol×24g/mol=4.8g
m(Al)=0.2mol×27g/mol=5.4g
答:原合金中镁的质量为4.8g、铝的质量为5.4g.
点评:本题考查化学方程式计算、混合物计算,比较基础,有利于基础知识的巩固.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
实验是化学研究的基础.下列对实验现象的描述错误的是( )
A、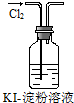 如图实验中溶液变黄色 |
B、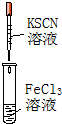 如图实验试管中混合溶液变血红色 |
C、 如图实验中烧瓶内溶液变红色 |
D、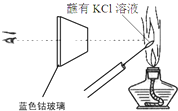 如图实验透过蓝色钴玻璃观察到火焰为紫色 |
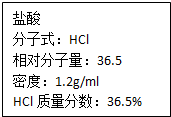 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: