题目内容
18.室温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 在澄清透明的溶液中:H+、Na+、SO42-、Cu2+ | |
| B. | 在$\frac{{K}_{w}}{c(O{H}^{-})}$=1 mol•L-1的溶液中:Na+、NH4+、I-、CO32- | |
| C. | 在0.1mol•L-1NaHSO4溶液中:K+、Fe2+、C1-、NO3- | |
| D. | 在能使甲基橙显黄色的溶液中:Ca2+、Ba2+、Br-、C1- |
分析 A.该离子之间不反应,能够共存;
B.在$\frac{{K}_{w}}{c(O{H}^{-})}$=1 mol•L-1的溶液中存在大量氢离子,碳酸根离子与氢离子反应;
C.硫酸氢钠溶液呈酸性,硝酸根离子在酸性条件下能够氧化亚铁离子;
D.在能使甲基橙显黄色的溶液的pH大于4.4,为酸性或碱性溶液,四种离子之间不反应,都不与氢离子、氢氧根离子反应.
解答 解:A.H+、Na+、SO42-、Cu2+之间不发生反应,为澄清透明溶液,在溶液中能够大量共存,故A正确;
B.在$\frac{{K}_{w}}{c(O{H}^{-})}$=1 mol•L-1的溶液中c(H+)=1 mol•L-1,CO32-与氢离子反应,在溶液中不能大量共存,故B错误;
C.NaHSO4会电离出氢离子,NO3-再酸性条件下可以氧化Fe2+,不能大量共存,故C错误;
D.在能使甲基橙显黄色的溶液的pH大于4.4,溶液中存在大量氢离子或氢氧根离子,Ca2+与氢氧根离子反应生成微溶物氢氧化钙,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案| A. | 温度一定,一个化学反应的平衡常数是一个常数 | |
| B. | 两种物质反应,不管怎样书写化学方程式,平衡常数不变 | |
| C. | 温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数 | |
| D. | 浓度商Qc<Kc,v(正)<v(逆) |

已知:部分阳离子以氢氧化物的形式完全沉淀时的pH如下表所示,回答下列间题
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
(2)为提高酸浸速率,可采取的措施有(答两条)将废催化剂粉碎或适当地提高硫酸的浓度、浸泡时的温度.
(3)向A中加人 H2O2时反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O.试剂x可以是蒸馏.
(4)用方程式表示出由沉淀.制取单质镍的方法Ni(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$NiO+H2O、2Al+2NiO $\frac{\underline{\;高温\;}}{\;}$Al2O3+3Ni.回收mkg上述废催化剂的过程中,若将溶液pH调整为6时消耗了akgNi(OH)2,从洗涤到得到滤液B的过程中镍的损失率为3%,后几步操作过程中镍的损失率为5%,则最终得到单质镍的质量为(70%×97%m+$\frac{59}{93}$a)×95%kg(填计算式).
(5)利用化学镀(待镀件直接置于含有镀层金属的化合物的溶液中)可以在金属、塑料、陶瓷等物品表面镀上一层金属镍或铬等金属,某化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生的反应之一如下,请配平该反应.与电镀相比,化掌镀的最大优点是:不消耗电能,节约能源.
 苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置图和有关数据如下:
苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置图和有关数据如下:| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
| 苯甲酸钠 | 144 | - | 249.3 | 易溶于水 |
(1)制备苯甲酸
在三颈瓶中加入4mL甲苯和20mL稀硫酸,放入碎瓷片后,加热至沸腾,加入12.8g高锰酸钾,加热到甲苯层消失.将三颈瓶在冰水浴中冷却,分离出苯甲酸.
①球形冷凝管的作用是冷凝回流,其进水口是b(填“a”或“b”).
②三颈瓶中反应的离子方程式
 .
.③分离苯甲酸选用的玻璃仪器是BCD(填标号)
A分液漏斗 B玻璃棒 C烧杯 D漏斗 E蒸馏烧瓶 F直形冷凝管
④分离出的苯甲酸晶体中可能含有的杂质是K2SO4、MnSO4,为进一步提纯,应采用的方法是重结晶.
(2)制备苯甲酸钠
控制温度为70℃,向三颈瓶中加入61.0g苯甲酸和适量的32%的碳酸钠溶液,充分反应后停止加热.在深色的溶液中加入活性炭,并将反应混合物过滤,得到无色透明的苯甲酸钠溶液,将滤液转入蒸发皿中,加热蒸发、冷却结晶,过滤、洗涤、干燥制得苯甲酸钠晶体.
⑤控制温度为70℃的方法是水浴加热.
⑥加入活性炭的作用是吸附色素.
⑦若提纯得到46.8g苯甲酸钠.则苯甲酸钠的产率是65.0%.
| A. | 0.1mol/L的盐酸溶液和0.1 mol/L的NaOH溶液 | |
| B. | pH=1的盐酸溶液和pH=13的Ba(OH)2溶液 | |
| C. | pH=4的醋酸溶液和pH=10的NaOH溶液 | |
| D. | pH=4的盐酸溶液和pH=10的NH3•H2O溶液 |
| A. | BaCl2溶液 | B. | NaOH饱和溶液 | C. | CuSO4溶液 | D. | 盐酸 |
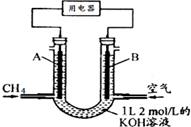 将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )| A. | OH-由A端移向B端 | |
| B. | 0<V≤22.4L时,电池总反应的化学方程式为:CH4+2O2+KOH═KHCO3+2H2O | |
| C. | 22.4L<V≤44.8L时,负极电极反应为:CH4-8e-+9CO32-+3H2O=10HCO3- | |
| D. | V=33.6L时,溶液中阴离子浓度大小关系为:c(CO32- )>c(HCO3- )>c(OH-) |
 .
. 呵护生存环境,共建和谐社会是当今社会的主题.
呵护生存环境,共建和谐社会是当今社会的主题.