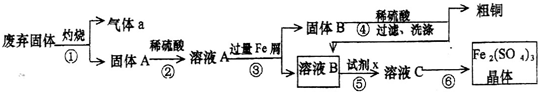
题目内容
9.将等量的Al分别放入到100mL 1.0mol/L的盐酸和100mL1.0mol/L的NaOH溶液中,放出的H2的物质的量之比为1:2,则铝的质量为1.8g.分析 由6HCl+2Al=2AlCl3+3H2↑和2NaOH+2Al+2H2O=2NaAlO2+3H2↑进行讨论,由反应可知①若Al在两个反应中均不足量,则生成的H2的物质的量之比为1:1,不符合题意;②若HCl、NaOH在反应中,由HCl、NaOH不足量且物质的量均为0.1mol,则生成的H2的物质的量之比为1:3,不符合题意;由以上两种情形可以分析得③反应中HCl不足量,NaOH过量,根据反应方程式可以求算出铝的质量.
解答 解:由6HCl+2Al=2AlCl3+3H2↑和2NaOH+2Al+2H2O=2NaAlO2+3H2↑
①若Al在两个反应中均不足量,则生成的H2的物质的量之比为1:1,不符合题意;
②若HCl、NaOH在反应中,由HCl、NaOH不足量且物质的量均为0.1mol,则生成的H2的物质的量之比为1:3,不符合题意;
两份等质量的Al都完全反应且生成H2的体积比为1:2可知③反应中HCl不足量,NaOH过量,
因为盐酸不足量根据反应6HCl+2Al=2AlCl3 +3H2↑可以得到生成H2的物质的量为0.05mol,
0.1L×1.0mol/L
则Al和 NaOH 反应时应生成H2的物质的量为 0.1mol,因在 2NaOH+2Al+2H2O=2NaAlO2+3H2↑反应中Al不足量可以推出Al的物质的量为$\frac{0.2}{3}$mol,Al的质量为$\frac{0.2}{3}$mol×27g/mol=1.8g,故答案为1.8g.
点评 本题考查铝与酸和碱反应生成氢气,根据产生氢气的体积之比,来进行过量问题的判断,然后根据不足来求解分析,比较难.

| 实验方案 | 实验现象 |
| 1.用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 2.向新制的H2S饱和溶液中滴加新制的氯水 3.钠与滴有酚酞试液的冷水反应 4.镁带与2mol/L的盐酸反应 5.铝条与2mol/L的盐酸反应 6.向AlCl3溶液中滴加NaOH溶液至过量 | A.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 B.产生大量气体,气体可燃,溶液变浅红色 C.反应不十分强烈,产生的气体可燃 D.剧烈反应,产生的气体可燃 E.生成白色絮状沉淀,继而沉淀消失 F.生成淡黄色沉淀 |
(1)实验目的:探究同周期元素的金属性和非金属性的递变规律;
(2)实验用品:仪器:①烧杯②试管③胶头滴管④试管夹⑤镊子⑥小刀⑦玻璃片⑧砂纸等;药品:钠、镁带、铝条、2mol•L-1的盐酸、新制的氯水、饱和的H2S溶液、AlCl3溶液、NaOH溶液等.
(3)实验内容:(填写与实验方案相对应的实验现象)1B2F3A4D5C6E(用A-F表示);写出③的离子方程式2Na+2H2O=2Na++2OH-+H2↑;
(4)实验结论:金属性:Na>Mg>Al;非金属性:Cl>S.
| A. | 质子数是212 | B. | 中子数是130 | C. | 电子数是194 | D. | 质量数是82 |
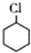 (一氯环己烷)$→_{II}^{NaOH,乙醇,△}$
(一氯环己烷)$→_{II}^{NaOH,乙醇,△}$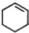 $→_{Ⅲ}^{Br_{2}的CCl_{4}溶液}$B$\stackrel{Ⅳ}{→}$
$→_{Ⅲ}^{Br_{2}的CCl_{4}溶液}$B$\stackrel{Ⅳ}{→}$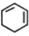

 .
.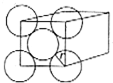 金晶体是面心立方最密堆积,立方体的每个面上5个金原子紧密堆砌(如图,其余各面省略),金原子半径为A cm,求:
金晶体是面心立方最密堆积,立方体的每个面上5个金原子紧密堆砌(如图,其余各面省略),金原子半径为A cm,求: