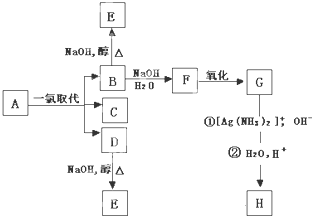
题目内容
用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,下列说法不正确的是( )
| A、18O存在于乙酸乙酯中 |
| B、18O存在于水中 |
| C、反应中浓硫酸即是催化剂又是脱水剂 |
| D、若与丙酸反应生成的酯的相对分子质量为104 |
考点:乙酸乙酯的制取
专题:
分析:羧酸跟醇的酯化反应是可逆的,该反应也属于取代反应;羧酸跟醇的反应过程为:羧酸分子中的羟基与醇分子中羟基的氢原子结合成水,其余部分互相结合成酯,即酸去羟基醇去羟基氢,据此判断含有18O的化合物,并计算出生成的乙酸乙酯的相对分子量.
解答:
解:A、乙酸与乙醇反应乙酸提供羟基,醇提供羟基氢原子,结合生成水,其余部分互相结合成酯,所以CH3CH218OH与乙酸反应方程式为:CH3COOH+CH3CH218OH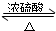 CH3CO18OCH2CH3+H2O,由于酯化反应是可逆反应,故乙醇仍存在,故18O只存在于乙醇和乙酸乙酯中,故A正确,B错误;
CH3CO18OCH2CH3+H2O,由于酯化反应是可逆反应,故乙醇仍存在,故18O只存在于乙醇和乙酸乙酯中,故A正确,B错误;
C、在此反应中浓硫酸的作用是:催化剂与脱水剂,故C正确;
D、生成的乙酸乙酯为:CH3CO18OCH2CH3,该酯的相对分子质量为90,若与丙酸反应生成的酯相对分子质量比乙酸乙酯大14,即90+14=104,故D正确;
故选B.
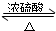 CH3CO18OCH2CH3+H2O,由于酯化反应是可逆反应,故乙醇仍存在,故18O只存在于乙醇和乙酸乙酯中,故A正确,B错误;
CH3CO18OCH2CH3+H2O,由于酯化反应是可逆反应,故乙醇仍存在,故18O只存在于乙醇和乙酸乙酯中,故A正确,B错误;C、在此反应中浓硫酸的作用是:催化剂与脱水剂,故C正确;
D、生成的乙酸乙酯为:CH3CO18OCH2CH3,该酯的相对分子质量为90,若与丙酸反应生成的酯相对分子质量比乙酸乙酯大14,即90+14=104,故D正确;
故选B.
点评:本题考查酯化反应的原理与特点,难度不大,注意羧酸跟醇的酯化反应是可逆的,羧酸跟醇的反应过程一般是:羧酸分子中的羟基与醇分子中羟基的氢原子结合成水,其余部分互相结合成酯.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3molA和2.5molB混合于容积为2L的容器内,使它们发生反应2A(s)+3B(g)?2C(g)+D(g),经过5min生成0.5molD,下列说法正确的是( )
| A、B的平均消耗速率为0.3mol/(L?min) |
| B、C的平衡浓度为2mol/L |
| C、平衡后,增大压强,平衡将向正方向移动 |
| D、若反应容器内气体的密度不再发生变化,说明反应已经达到平衡 |
在一定条件下能作为合成的单体是( )
A、 |
| B、H2N(CH2)5COOH |
| C、HO(CH2)5COOH和HO(CH2)5NH2 |
| D、HOOC(CH2)4COOH和H2N(CH2)5NH2 |