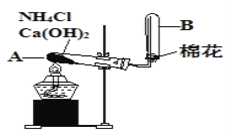
题目内容
【题目】阿伏加德罗常数的值为NA,下列说法正确的是( )
A. 用惰性电极电解1 L 1mol/L CuSO4溶液,阴极得到的铜原子的数目一定为NA
B. 将2.3g钠投入到100ml 0.8mol/L的稀盐酸中,完全反应后可得到H2的数目为0.01NA
C. 1molCl2溶于水后溶液中Cl2、HClO、ClO-、Cl-四种粒子总数为2NA
D. 标准状况下,2molNa2O2与44.8LSO2完全反应,转移的电子数目为4NA
【答案】D
【解析】A. 没有说明电解的程度,无法确定阴极得到的铜原子的数目,选项A错误;B.2.3g钠为0.1mol,根据反应![]() 可知,完全反应后可得到H2的数目为0.05NA,选项B错误;C. 根据物料守恒有2n(Cl2)+n(HClO)+n(ClO-)+n(Cl-)=2mol,1molCl2溶于水后溶液中Cl2、HClO、ClO-、Cl-四种粒子总数小于2NA,选项C错误;D. 根据反应Na2O2+ SO2= Na2SO4可知,标准状况下,2molNa2O2与44.8LSO2完全反应,转移的电子数目为4NA,选项D正确。答案选D。
可知,完全反应后可得到H2的数目为0.05NA,选项B错误;C. 根据物料守恒有2n(Cl2)+n(HClO)+n(ClO-)+n(Cl-)=2mol,1molCl2溶于水后溶液中Cl2、HClO、ClO-、Cl-四种粒子总数小于2NA,选项C错误;D. 根据反应Na2O2+ SO2= Na2SO4可知,标准状况下,2molNa2O2与44.8LSO2完全反应,转移的电子数目为4NA,选项D正确。答案选D。

【题目】用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
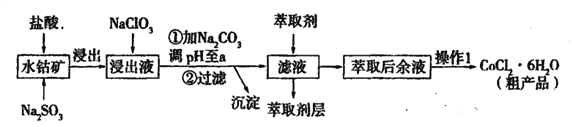
已知:①浸出液含有的阳离子主要有,H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe( OH)3 | Fe(OH)2 | Co(OH)2 | Al( OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)①浸出过程中加入Na2SO3的目的是____。
②向浸出液中加入NaClO3的离子反应方程式为____。
③为提高浸取率除了适当增大NaClO3浓度,升高温度还可采取措施____(答一条即可)。若不慎向“浸出液”中加入NaClO3过量时,可能会生成有毒气体,写出生成该有毒气体的离子方程式____。
(2)①“加Na2CO3调pH至a”,过滤所得到的沉淀成分为____。
②萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是____;其使用的适宜pH范围是____(填编号)。
A.2.0—2.5 B. 3.0—3.5 C.4.0—4.5 D.5.0—5.5

③“操作1”中包含的基本实验操作,它们依次是_______、____和过滤、减压烘干。
(3)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤,洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是____(答一条即可)。