题目内容
有关NaHCO3 和Na2CO3 性质,以下叙述错误的是( )
| A、往饱和碳酸钠溶液中通入足量CO2 ,溶液变浑浊 |
| B、往同物质的量浓度的两种溶液中滴入等量酚酞,Na2CO3 溶液红色更深 |
| C、将澄清石灰水加入NaHCO3 溶液中不产生沉淀,加入Na2CO3 溶液中产生白色沉淀 |
| D、同物质的量浓度同体积的两种溶液与Ca(OH)2 反应均完全转变为CaCO3,Na2CO3溶液消耗的大于NaHCO3溶液 |
考点:钠的重要化合物
专题:元素及其化合物
分析:A.往饱和碳酸钠溶液中通入足量CO2 ,生成溶解度更小的NaHCO3 ;
B.Na2CO3水解程度更大;
C.二者都与氢氧化钙反应;
D.可结合反应的方程式判断.
B.Na2CO3水解程度更大;
C.二者都与氢氧化钙反应;
D.可结合反应的方程式判断.
解答:
解:A.往饱和碳酸钠溶液中通入足量CO2 ,生成溶解度更小的NaHCO3 ,则溶液变混浊,故A正确;
B.CO32-以第一步水解为主,则Na2CO3溶液的碱性较强,故B正确;
C.Na2CO3和NaHCO3都能与澄清的石灰水反应生成沉淀,故C错误;
D.都与澄清石灰水反应生成沉淀:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O(NaHCO3足量),由方程式可知Na2CO3溶液消耗的大于NaHCO3溶液,故D正确.
故选C.
B.CO32-以第一步水解为主,则Na2CO3溶液的碱性较强,故B正确;
C.Na2CO3和NaHCO3都能与澄清的石灰水反应生成沉淀,故C错误;
D.都与澄清石灰水反应生成沉淀:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O(NaHCO3足量),由方程式可知Na2CO3溶液消耗的大于NaHCO3溶液,故D正确.
故选C.
点评:本题考查Na2CO3和NaHCO3性质的异同,题目难度不大,注意把握Na2CO3和NaHCO3性质,注重基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
一溴代烃A经水解后再氧化得到有机化合物B,A的一种同分异构体经水解得到有机化合物C,B和C可发生酯化反应生成酯D,则D可能是( )
| A、(CH3)2CHCOOC(CH3)3 |
| B、(CH3)2CHCOOCH2CH(CH3)2 |
| C、(CH3)2CHCOOCH(CH3)CH2CH3 |
| D、CH3(CH2)2COOCH2(CH2)2CH3 |
在一定条件下,同一物质中不能自身相互发生反应的是( )
| A、乙醇 | B、氨基酸 |
| C、乙烯 | D、硬脂酸 |
甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,对下列叙述的判断正确的是( )
①甲由水电离出来的H+的物质的量浓度是乙的
倍
②物质的量浓度c(甲)=10c(乙)
③中和等物质的量的NaOH溶液需甲、乙两杯酸的体积,10V(甲)=V(乙)
④甲中的c(OH-)为乙中的c(OH-)的10倍.
①甲由水电离出来的H+的物质的量浓度是乙的
| 1 |
| 10 |
②物质的量浓度c(甲)=10c(乙)
③中和等物质的量的NaOH溶液需甲、乙两杯酸的体积,10V(甲)=V(乙)
④甲中的c(OH-)为乙中的c(OH-)的10倍.
| A、①②④正确 | B、①③正确 |
| C、②④正确 | D、只有①正确 |
下列关于物质的使用叙述不合理的是( )
| A、亚硝酸钠是常用的防腐剂 |
| B、婴儿食品可添加着色剂,以增加婴儿对食物的兴趣 |
| C、维生素C可防治坏血病,因而我们需要大量补充维生素C |
| D、药物可以帮助我们战胜疾病,但我们仍需合理用药 |


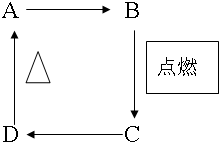 中学化学中常见化合物A、B、C、D的转化关系如图(某些反应物、产物略去).常温下B、C都是气体,又知A、C都是酸性氧化物,其中A是一种高熔点化合物,不溶于硫酸、硝酸、却溶于氢氟酸,固体C可用于人工降雨
中学化学中常见化合物A、B、C、D的转化关系如图(某些反应物、产物略去).常温下B、C都是气体,又知A、C都是酸性氧化物,其中A是一种高熔点化合物,不溶于硫酸、硝酸、却溶于氢氟酸,固体C可用于人工降雨