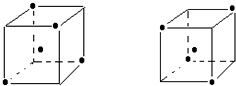
题目内容
键能的大小可以衡量化学键的强弱.下列说法中错误的是( )
|
分析:A、SiCl4的是分子晶体,SiC是原子晶体,熔点原子晶体>分子晶体;
B、H-I键的键长比H-Cl长,键长越短键能越大,化学键越稳定,氢化物越稳定;
C、键长越短化学键越稳定,键能越大;
D、晶体硅中1个Si原子与周围的4个Si形成正四面体空间网状结构,每个Si原子形成4个Si-Si键,每个Si-Si键为1个Si原子通过
Si-Si键,所以1mol晶体硅中含有Si-Si键为1mol×4×
=2mol.
B、H-I键的键长比H-Cl长,键长越短键能越大,化学键越稳定,氢化物越稳定;
C、键长越短化学键越稳定,键能越大;
D、晶体硅中1个Si原子与周围的4个Si形成正四面体空间网状结构,每个Si原子形成4个Si-Si键,每个Si-Si键为1个Si原子通过
| 1 |
| 2 |
| 1 |
| 2 |
解答:解:A、SiCl4的是分子晶体,SiC是原子晶体,熔点原子晶体>分子晶体,所以SiCl4的熔点比SiC熔点低,故A正确;
B、H-I键的键长比H-Cl长,键长越短键能越大,化学键越稳定,氢化物越稳定,所以HCl的稳定性比HI稳定性高,故B正确;
C、C原子半径小于Si原子半径,C-C键的键长比Si-Si键的短,键长越短化学键越稳定,键能越大,所以C-C的键能大于Si-Si,故C正确;
D、晶体硅中1个Si原子与周围的4个Si形成正四面体空间网状结构,每个Si原子形成4个Si-Si键,每个Si-Si键为1个Si原子通过
Si-Si键,所以1mol晶体硅中含有Si-Si键为1mol×4×
=2mol,拆开1mol晶体硅中的化学键所吸收的能量为176kJ/mol×2mol=352kJ,故D错误.
故选D.
B、H-I键的键长比H-Cl长,键长越短键能越大,化学键越稳定,氢化物越稳定,所以HCl的稳定性比HI稳定性高,故B正确;
C、C原子半径小于Si原子半径,C-C键的键长比Si-Si键的短,键长越短化学键越稳定,键能越大,所以C-C的键能大于Si-Si,故C正确;
D、晶体硅中1个Si原子与周围的4个Si形成正四面体空间网状结构,每个Si原子形成4个Si-Si键,每个Si-Si键为1个Si原子通过
| 1 |
| 2 |
| 1 |
| 2 |
故选D.
点评:本题考查晶体类型与性质、键能概念及键能键长的运用等,难度中等,D选项为易错点,要根据晶体结构判断1mol晶体硅中含有Si-Si键为2mol.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
 有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物;B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物.
有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物;B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物.
 键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题: