题目内容
9.目前含有元素硒(Se)的保健品已开始涌入市场,已知它与氧同主族,而与钾同周期,下列关于硒的有关描述中错误的是( )| A. | 原子序数34 | B. | 最高价氧化物为SeO2 | ||
| C. | 原子半径比钾小 | D. | 气态氢化物化学式为H2Se |
分析 A、同主族相邻的3、4两周期元素原子序数差18;
B、第ⅥA族,最高正化合价等于族序数;
C、同周期主族元素自左而右原子半径逐渐减小;
D、主族非金属元素,最高正化合价-8=最低负化合价.
解答 解:A、同主族相邻的3、4两周期元素原子序数差18,硫是16号,所以硒是34号,即原子序数为34,故A正确;
B、硒是第ⅥA族,最高正化合价等于族序数,最高正价为+6,对应的氧化物化学式为SeO3,故B错误;
C、同周期主族元素自左而右原子半径逐渐减小,硒与钾同周期,在钾的右边,原子半径硒小于钾,故C正确;
D、主族非金属元素,最高正化合价-8=最低负化合价,硒的最低负化合价=6-8=-2,对应的氢化物的化学式为H2Se,故D正确.
故选B.
点评 本题考查学生同一周期和同一主族元素性质的递变规律,题目难度不大,侧重于元素周期律的考查,注意基础知识的积累.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
19.常温下将盛有10mLNO2和10mLNO混合气体的试管倒立于水槽中,并向其中通入O2一段时间后,试管内剩余2mL气体,则通入O2的体积为( )
| A. | 8mL | B. | 9mL | C. | 10mL | D. | 12mL |
17.关于实验室制乙炔的说法不正确的是( )
| A. | 因反应太剧烈,可用分液漏斗控制滴水速度来控制反应速度 | |
| B. | 为了得到比较平缓的乙炔气流,可用饱和食盐水代替水 | |
| C. | 乙炔气体中混有PH3和H2S等杂质,可用硫酸铜溶液将其除去 | |
| D. | 为控制反应的速率,可用碳化钙粉末和饱和食盐水反应 |
1.下列物质的变化中,有共价键明显被破坏的是( )
| A. | I2升华 | B. | NaCl颗粒被粉碎 | ||
| C. | 溴蒸汽被木炭吸附 | D. | 从NH4HCO3中闻到了刺激性气味 |
19.下表是元素周期表的一部分,针对a~K十一种元素回答下列问题(请用具体化学式回答,否则不给分)
(1)这些元素中非金属性最强的单质是F2,最高价氧化物对应水化物酸性最强的是HClO4,最高价氧化物对应水化物碱性最强的是NaOH.
(2)表中K的氢化物的化学式为HCl,它的还原性比j的氢化物还原性弱(填“强”或“弱”),它水溶液的酸性比j的氢化物水溶液的酸性强(填“强”或“弱”).
(3)e单质为N2,其结构式为N≡N.
(4)用电子式表示h与k构成化合物的形成过程
(5)写出i的氧化物与强碱溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O
(6)H2和e的单质化合的反应是可逆反应,且该反应正方向放热.将等物质的量的H2、e的单质充入一恒容密闭容器中,在适当条件下反应.下列说法正确的是ACD(填写选项).
A.升高温度,不论正反应方向还是逆反应方向速率都加快
B.向上述容器中充入适量Ar气可加快反应速率
C.反应过程中,e的单质的体积分数始终为50%
D.反应器内压强不随时间变化而变化,说明反应到达平衡.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | a | c | d | e | f | g | |
| 3 | b | h | i | j | k |
(2)表中K的氢化物的化学式为HCl,它的还原性比j的氢化物还原性弱(填“强”或“弱”),它水溶液的酸性比j的氢化物水溶液的酸性强(填“强”或“弱”).
(3)e单质为N2,其结构式为N≡N.
(4)用电子式表示h与k构成化合物的形成过程

(5)写出i的氧化物与强碱溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O
(6)H2和e的单质化合的反应是可逆反应,且该反应正方向放热.将等物质的量的H2、e的单质充入一恒容密闭容器中,在适当条件下反应.下列说法正确的是ACD(填写选项).
A.升高温度,不论正反应方向还是逆反应方向速率都加快
B.向上述容器中充入适量Ar气可加快反应速率
C.反应过程中,e的单质的体积分数始终为50%
D.反应器内压强不随时间变化而变化,说明反应到达平衡.
 .
. ,所含的化学键类型为离子键、共价键.
,所含的化学键类型为离子键、共价键. .
.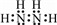 .
. ,N采用sp3杂化方式,粒子空间构型为V型.
,N采用sp3杂化方式,粒子空间构型为V型.