题目内容
纯水是极弱的电解质,在20℃时,纯水中![]() ,欲使水的电离平衡向正方向移动,并使氢离子浓度增大,应加入的适当物质是下列中的
,欲使水的电离平衡向正方向移动,并使氢离子浓度增大,应加入的适当物质是下列中的
[ ]
|
A.明矾 |
B. |
|
C. |
D. |
解析:
|
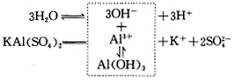
本题对选项的要求有2点:一是能使水的电离平衡向正方向移动,另一个是使氢离子浓度增大,溶液呈现酸性.当在纯水中加入明矾时,明矾溶解、电离产生的铝离子,能与水电离产生的氢氧根离子结合,生成
当水的电离达到新平衡时,
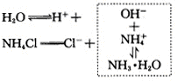
但达到新的电离平衡时,溶液中的氢氧根离子浓度增大,溶液呈现碱性,所以,选项C也不符合题意;当在纯水中加入氯化铵时,铵离子可以跟水电离出来的氢氧根离子结合,生成一水合氨分子,使水的电离平衡向正方向移动:
达到新平衡时,溶液中的氢离子浓度增大,溶液呈现酸性,所以,选项D同样符合题意. |
提示:
|
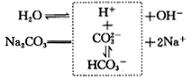
在纯水中加入强酸,使水的电离平衡向逆向移动,溶液呈现酸性;在纯水中加入弱碱强酸盐,使水的电离平衡向正向移动,溶液呈现酸性.要注意在这两种情况下,水的电离平衡移动方向上的本质差异. |

过氧乙酸 本品包括甲、乙两种溶液,体积各500 mL,把甲、乙溶液各1份在玻璃容器中混合后放置24小时后,其中过氧乙酸浓度小少于10%,应用50倍纯水稀释(浓度为0.2%),稀释后才能使用。 |
有关资料:H2O2是极弱的电解质,在酸性介质中才能稳定存在,是一种强氧化剂。过氧乙酸消毒液是由H2O2、H2O、CH3COOH及少量H2S4O混合后,反应生成过氧乙酸(CH3COOOH),反应的化学方程式:CH3COOH+H2O2![]() CH3COOOH+H2O。CH3COOOH容易放出氧原子,它与空气中微生物机体作用,达到灭菌目的,是消毒液的主要成分。
CH3COOOH+H2O。CH3COOOH容易放出氧原子,它与空气中微生物机体作用,达到灭菌目的,是消毒液的主要成分。
(1)某研究性学习小组为了弄清配制过氧乙酸消毒液的甲、乙溶液的主要成分各是什么?进行以下科学探究,请你完成下列相关内容:
①提出假设:甲溶液的主要成分为_________,乙溶液的主要成分为_________。
②实验验证:取甲、乙两种溶液少许,分别加入几滴_________试液,甲溶液的现象为_________,乙溶液的现象为______________________________________________________。
③得出结论:甲溶液的主要成分为_________,乙溶液的主要成分为_________。
(2)有关过氧乙酸的叙述正确的是_________ (填编号)
A.过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体
B.过氧乙酸与苯酚混合使用可增强消毒效果
C.过氧乙酸与乙酸属于同系物
下列说法中正确的是( )
| A.水是极弱的电解质,它能微弱电离生成H+,所以严格地说纯水呈微酸性 |
| B.纯水中c(OH-)×c(H+)=Kw,Kw是一常数,不随任何条件改变而改变 |
| C.25℃时纯水中c(OH-)×c(H+)=10-14,稀酸和稀碱中Kw=c(OH-)×c(H+)≠10-14 |
D.H2O  H++OH-是吸热过程,所以温度升高,平衡向电离方向移动,KW随之增大 H++OH-是吸热过程,所以温度升高,平衡向电离方向移动,KW随之增大 |
 H++OH-是吸热过程,所以温度升高,平衡向电离方向移动,KW随之增大
H++OH-是吸热过程,所以温度升高,平衡向电离方向移动,KW随之增大