题目内容
15.下列反应的离子方程式正确的是( )| A. | 氨水与盐酸反应:OH-+H+═H2O | |
| B. | 锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu | |
| C. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氢氧化钡与硫酸反应:Ba2++SO42-═BaSO4↓ |
分析 A.NH3•H2O是弱碱,不能拆成离子形式;
B.二者发生置换反应生成硫酸锌和铜;
C.不符合反应客观事实;
D.漏掉氢离子与氢氧根离子的反应.
解答 解:A.氨水与盐酸反应,离子方程式:NH3•H2O+H+═H2O+NH4+,故A错误;
B.锌与硫酸铜溶液反应,离子方程式:Zn+Cu2+═Zn2++Cu,故B正确;
C.铁与稀盐酸反应生成氯化亚铁和氢气,离子方程式:Fe+2H+═Fe2++H2↑,故C错误;
D.氢氧化钡与硫酸反应:Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子反应遵循客观事实、遵循原子个数守恒规律,题目难度不大.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
5.在2L密闭容器中进行反应:A+3B?2C,在10秒内反应物A的物质的量由1mol降到0.6mol,则反应速率v(C)为( )
| A. | 0.04 mol/(L•s) | B. | 0.08 mol/(L•s) | C. | 0.4 mol/(L•s) | D. | 0.8 mol/(L•s) |
6.既能用浓硫酸干燥,又能用碱石灰干燥的气体是( )
| A. | SO2 | B. | CH4 | C. | Cl2 | D. | NH3 |
3.下列能量的转化属于化学能直接转化为热能的是( )
| A. | 微波加热食物 | B. | 植物的光合作用 | C. | 水力发电 | D. | 化石燃料的燃烧 |
10.设NA为阿伏加德罗常数的数值,下列对0.3mol/L K2SO4溶液的说法中,正确的是( )
| A. | 1 L溶液中K+浓度是0.3 mol/L | B. | 1 L溶液中含0.3NA个K+ | ||
| C. | 2 L溶液中K+浓度是1.2 mol/L | D. | 2 L溶液中含1.2NA个K+ |
20.反应C(s)+H2O(g)?CO(g)+H2(g)在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A. | 增加少量的C | |
| B. | 将容器的体积缩小为原来的一半 | |
| C. | 保持体积不变,充入H2使体系压强增大 | |
| D. | 保持压强不变,充入N2使容器体积增大 |
7.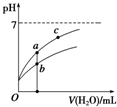 25℃时某些弱酸的电离平衡常数如下表所示:
25℃时某些弱酸的电离平衡常数如下表所示:
常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如图所示,下列说法正确的是( )
 25℃时某些弱酸的电离平衡常数如下表所示:
25℃时某些弱酸的电离平衡常数如下表所示:| CH3COOH | HClO | H2CO3 |
| K(CH3COOH) =1.8×10-5 | K(HClO) =3.0×10-8 | K(H2CO3)a1=4.4×10-7 K(H2CO3)a2=4.7×10-11 |
| A. | 相同浓度的CH3COOH和HClO的混合溶液中,各离子浓度的大小关系是:c(H+)>c(ClO-)>c(CH3COO-)>c(OH-) | |
| B. | 图象中a、c两点所处的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表CH3COOH或HClO) | |
| C. | 图象中a点酸的浓度大于b点酸的浓度 | |
| D. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32- |
5.下列离子方程式正确的是( )
| A. | 向含有Fe203的悬浊液中通入HI:Fe203+6H+═2Fe3++3H20 | |
| B. | 1 mol/L NaAl02溶液和1.5 mol/L HC1溶液等体积混合:6AlO2-+9H++3H2O═5A1(OH)3+Al3+ | |
| C. | 向Ca( Cl0)2溶液中通入S02:Ca2++2ClO-+S02+H20═CaSO3+2HC1O | |
| D. | 向0.1 mol/LpH=l的NaHA溶液中加入NaOH溶液:HA-+OH-═H2O+A2- |
