题目内容
工业废水中Cr(Ⅲ)回收与再利用工艺如下:
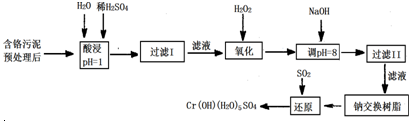
注:
①硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+
②部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表.
(1)酸浸时,为了提高浸取率可采取的措施 (至少写一条).
(2)调pH=8是为了除去 离子(选填:Fe3+、Al3+、Ca2+、Mg2+).
(3)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是 (选填:Fe3+、Al3+、Ca2+、Mg2+).

注:
①硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+
②部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表.
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(2)调pH=8是为了除去
(3)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是
考点:物质分离和提纯的方法和基本操作综合应用,难溶电解质的溶解平衡及沉淀转化的本质
专题:实验设计题
分析:(1)酸浸时,为了提高浸取率可采取的措施是延长浸取时间、加快溶解速度等措施;硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,酸浸是溶解物质为了提高浸取率,可以升高温度增大物质溶解度,增大接触面积增大反应速率,或加快搅拌速度等;
(2)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,Fe3+、Al3+转化为沉淀除去;
(3)钠离子交换树脂交换的离子是钙离子和镁离子.
(2)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,Fe3+、Al3+转化为沉淀除去;
(3)钠离子交换树脂交换的离子是钙离子和镁离子.
解答:
解:流程原理:硫酸浸取液中金属离子是Cr3+、Fe3+、Al3+、Ca2+、Mg2+,加入硫酸,将物质溶解酸化,过滤,除去难溶物质,然后向混合液中加入氢氧化钠,根据表中数据,加入NaOH溶液使溶液呈碱性,调节溶液PH=8,可以将Fe3+、Al3+转化为沉淀除去,将Fe3+、Al3+沉淀完全了,余下的只有Ca2+、Mg2+可以用钠离子交换树脂交换即可.
(1)酸浸时,为了提高浸取率可采取的措施是:增加浸取时间、不断搅拌混合物、滤渣多次浸取等,
故答案为:增加浸取时间、不断搅拌混合物、滤渣多次浸取等;
(2)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,溶液PH=8,Fe3+、Al3+转化为沉淀除去;
故答案为:Fe3+、Al3+;
(3)前面已将Fe3+、Al3+沉淀完全了,余下的只有Ca2+、Mg2+,此小题类似于磺化煤交换Ca2+、Mg2+原理,钠离子交换树脂交换的离子是钙离子和镁离子,故答案为:Ca2+、Mg2+;
(1)酸浸时,为了提高浸取率可采取的措施是:增加浸取时间、不断搅拌混合物、滤渣多次浸取等,
故答案为:增加浸取时间、不断搅拌混合物、滤渣多次浸取等;
(2)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,溶液PH=8,Fe3+、Al3+转化为沉淀除去;
故答案为:Fe3+、Al3+;
(3)前面已将Fe3+、Al3+沉淀完全了,余下的只有Ca2+、Mg2+,此小题类似于磺化煤交换Ca2+、Mg2+原理,钠离子交换树脂交换的离子是钙离子和镁离子,故答案为:Ca2+、Mg2+;
点评:本题考查了离子方程式、化学方程式的书写、物质的分离等知识点,难度较大,注意会运用溶液的pH值对溶液中的离子进行分离,除杂的原则是:除去杂质且不引进新的杂质.

练习册系列答案
相关题目
下列各种仪器:①漏斗; ②容量瓶; ③蒸馏烧瓶; ④分液漏斗; ⑤天平; ⑥量筒; ⑦胶头滴管,常用于物质分离的是( )
| A、①③⑦ | B、②⑥⑦ |
| C、①③④ | D、③④⑥ |
 (其中I、II为未知部分的结构)为推测X的分子结构,进行如图的转化:
(其中I、II为未知部分的结构)为推测X的分子结构,进行如图的转化:

 2014年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
2014年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.