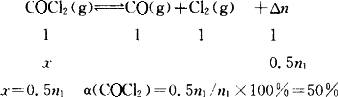题目内容
一定温度和压强下,使COCl2发生分解:
COCl2(g)达到化学平衡时,混合气体的密度是同条件下氢气密度的33倍,求COCl2的转化率.
答案:
解析:
提示:
解析:
|
答案:COCl2的转化率为50%. 解析:混合气体的密度是同条件下氢气密度的33倍,则 平衡混合气体的平均摩尔质量是2 g/mol×33=66 g/mol COCl2气体的摩尔质量是99 g/mol 相同质量的不同气体,摩尔质量与物质的量之间的关系是M1∶M2=n2∶n1 平衡混合气体的物质的量n2=M1n1/M2=(99 g·mol-1×n1)/66 g·mol-1=1.5n1 设COCl2分解了的物质的量是x.
|
提示:
|
从此题可以看出,运用差量法解化学平衡题的关键在于从给出数据中找出发生反应时各物质的相关量间的关系,统一转化成△n. |

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目