题目内容
(2013?济宁一模)化学反应变化过程及结果的研究.按要求回答问题:(1)关于反应过程中能量变化的研究:

则:2CO(g)+O2(g)=2CO2(g)△H=
(2)关于反应速率和限度的研究:
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:
2NH3 (g)+CO2 (g)?CO(NH2)2 (l)+H2O (l),该反应的平衡常数(K)和温度(T/℃)关系如下:
①焓变△H
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
=x,如图(1)是氨碳比(x)与CO2平衡转化率(α)的关系.α随着x增大而增大的原因是
③图(1)中的B点处,NH3的平衡转化率为
(3)关于电化学的研究:
铝是日常生活中用途最多的金属元素,如图(2)为Al-AgO电池的构造简图,电解质溶液为NaOH,它可用作水下动力电源,该电池中铝电极反应式为

(4)关于电离平衡的研究:
CO2+H2O?H2CO3
HCO3-人体血液里存在重要的酸碱平衡:,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒.其pH随c(HCO3-):c(H2CO3)变化关系如下表:
试回答:
①正常人体血液中,HCO3-的水解程度
②人体血液酸中毒时,可注射缓解
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
③pH=7.00的血液中,c(H2CO3)

则:2CO(g)+O2(g)=2CO2(g)△H=
-(a-2b+4c)
-(a-2b+4c)
kJ?mol-1.(2)关于反应速率和限度的研究:
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:
2NH3 (g)+CO2 (g)?CO(NH2)2 (l)+H2O (l),该反应的平衡常数(K)和温度(T/℃)关系如下:
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
<
<
0 (填“>”、“<”或“=”).②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
| n(NH3) |
| n(CO2) |
c(NH3)增大,平衡正向移动
c(NH3)增大,平衡正向移动
.③图(1)中的B点处,NH3的平衡转化率为
32
32
%.(3)关于电化学的研究:
铝是日常生活中用途最多的金属元素,如图(2)为Al-AgO电池的构造简图,电解质溶液为NaOH,它可用作水下动力电源,该电池中铝电极反应式为
Al+4OH--3e-=AlO2-+2H2O
Al+4OH--3e-=AlO2-+2H2O
.用该电池电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图(3)(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
.
(4)关于电离平衡的研究:
CO2+H2O?H2CO3
| OH- |
| H+ |
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
①正常人体血液中,HCO3-的水解程度
大于
大于
电离程度(填“大于”、“小于”、“等于”);②人体血液酸中毒时,可注射缓解
B
B
(填选项);A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
③pH=7.00的血液中,c(H2CO3)
<
<
c(HCO3-) (填“<”、“>”、“=”)分析:(1)依据热化学方程式和盖斯定律计算得到;
(2)①依据平衡常数随温度变化分析判断反应吸热放热;
②增大反应物浓度,平衡正向进行;
③依据x含义和图象数据分析结合化学方程式换算氨气转化率;
(3)该原电池中,铝易失去电子作负极,则银是正极,负极上铝和氢氧化钠反应生成偏铝酸钠,正极上氧化银得电子生成银,据此写出电池反应式;
(4)①根据人体血液的酸碱性确定碳酸氢根离子的电离和水解程度相对大小;
②发生酸中毒时,应该用碱性物质缓解;
③pH=6.1的血液中c(H2CO3)=c(HCO3-);
(2)①依据平衡常数随温度变化分析判断反应吸热放热;
②增大反应物浓度,平衡正向进行;
③依据x含义和图象数据分析结合化学方程式换算氨气转化率;
(3)该原电池中,铝易失去电子作负极,则银是正极,负极上铝和氢氧化钠反应生成偏铝酸钠,正极上氧化银得电子生成银,据此写出电池反应式;
(4)①根据人体血液的酸碱性确定碳酸氢根离子的电离和水解程度相对大小;
②发生酸中毒时,应该用碱性物质缓解;
③pH=6.1的血液中c(H2CO3)=c(HCO3-);
解答:解:(1)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-aKJ/mol
②CH3OH(l)+O2(g)=CO(g)+H2O(l)△H=-bKJ/mol
③H2O(g)=H2O(l)△H=-cKJ/mol
依据盖斯定律①-(②×2-③×4)得到:2CO(g)+O2(g)=2CO2(g)△H=-(a-2b+4c)KJ/mol;
故答案为:-(a-2b+4c);
(2)①平衡常数随温度升高减小,说明正反应为放热反应,△H<0,故答案为:<;
②2NH3 (g)+CO2 (g)?CO(NH2)2 (l)+H2O (l),图象分析判断,增大氨气浓度平衡正向进行,故答案为:c(NH3)增大,平衡正向移动;
③B点处x=4,原料气中的NH3和CO2的物质的量之比为4,二氧化碳转化率为64%,假设氨气为4,二氧化碳为1,则反应的二氧化碳为0.64,2NH3 (g)+CO2 (g)?CO(NH2)2 (l)+H2O (l),依据化学方程式反应的氨气为1.28,
NH3的平衡转化率=
×100%=32%
故答案为:32%;
(3)铝做负极,失电子被氧化,在碱性溶液中生成NaAlO2,氧化银做正极,得电子被还原为Ag,电解质溶液为NaOH溶液,所以其电池反应式为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O.所以负极电极反应为:Al+4OH--3e-=AlO2-+2H2O;用该电池电解尿素[CO(NH2)2]的碱性溶液制氢,电解池中的阳极为尿素失电子发生氧化反应,在碱性溶液中生成氮气和碳酸根离子,电极反应为,CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;
故答案为:Al+4OH--3e-=AlO2-+2H2O; CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;
(4)①人体血液pH值保持在7.35---7.45之间,则HCO3-的水解程度大于电离程度;
故答案为:大于;
②发生酸中毒时,应用碱性物质缓解;
A.NaOH溶液是强碱溶液具有强腐蚀性,故A不符合;
B.NaHCO3溶液水解显碱性,可以和酸反应起到缓解人体血液酸中毒,故B符合;
C.NaCl溶液是中性溶液不起作用,故C不符合;
D.Na2SO4溶液是中性溶液不能缓解血液的酸性,故D不符合;
故答案为:B;
③pH=7.00的血液中c(H2CO3)<c(HCO3-);
故答案为:<;
②CH3OH(l)+O2(g)=CO(g)+H2O(l)△H=-bKJ/mol
③H2O(g)=H2O(l)△H=-cKJ/mol
依据盖斯定律①-(②×2-③×4)得到:2CO(g)+O2(g)=2CO2(g)△H=-(a-2b+4c)KJ/mol;
故答案为:-(a-2b+4c);
(2)①平衡常数随温度升高减小,说明正反应为放热反应,△H<0,故答案为:<;
②2NH3 (g)+CO2 (g)?CO(NH2)2 (l)+H2O (l),图象分析判断,增大氨气浓度平衡正向进行,故答案为:c(NH3)增大,平衡正向移动;
③B点处x=4,原料气中的NH3和CO2的物质的量之比为4,二氧化碳转化率为64%,假设氨气为4,二氧化碳为1,则反应的二氧化碳为0.64,2NH3 (g)+CO2 (g)?CO(NH2)2 (l)+H2O (l),依据化学方程式反应的氨气为1.28,
NH3的平衡转化率=
| 1.28 |
| 4 |
故答案为:32%;
(3)铝做负极,失电子被氧化,在碱性溶液中生成NaAlO2,氧化银做正极,得电子被还原为Ag,电解质溶液为NaOH溶液,所以其电池反应式为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O.所以负极电极反应为:Al+4OH--3e-=AlO2-+2H2O;用该电池电解尿素[CO(NH2)2]的碱性溶液制氢,电解池中的阳极为尿素失电子发生氧化反应,在碱性溶液中生成氮气和碳酸根离子,电极反应为,CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;
故答案为:Al+4OH--3e-=AlO2-+2H2O; CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;
(4)①人体血液pH值保持在7.35---7.45之间,则HCO3-的水解程度大于电离程度;
故答案为:大于;
②发生酸中毒时,应用碱性物质缓解;
A.NaOH溶液是强碱溶液具有强腐蚀性,故A不符合;
B.NaHCO3溶液水解显碱性,可以和酸反应起到缓解人体血液酸中毒,故B符合;
C.NaCl溶液是中性溶液不起作用,故C不符合;
D.Na2SO4溶液是中性溶液不能缓解血液的酸性,故D不符合;
故答案为:B;
③pH=7.00的血液中c(H2CO3)<c(HCO3-);
故答案为:<;
点评:本题考查了热化学方程式和盖斯定律的计算应用,原电池,电解池原理的应用,电极反应书写方法,化学平衡影响因素的分析判断,盐类水解的分析,题目难度中等.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
 (2013?济宁一模)元素X的单质及X与Y形成的化合物能按如图所示的关系发生转化(其中m≠n,且均为正整数).下列说法正确的是( )
(2013?济宁一模)元素X的单质及X与Y形成的化合物能按如图所示的关系发生转化(其中m≠n,且均为正整数).下列说法正确的是( )
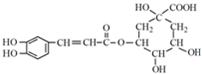 )是一种抗氧化药物,存在如图转化关系.
)是一种抗氧化药物,存在如图转化关系.

 或
或