题目内容
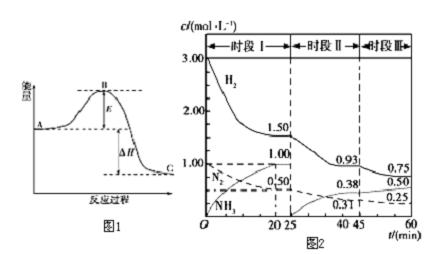
N2(g)+3H2(g)?2NH3(g)反应过程的能量变化如图1所示.已知生成1mol NH3(g)的△H=-46kJ?mol-1.请回答下列问题:
(1)图中A、C分别表示 、 ;若该反应使用催化剂,会使图中B点升高还是降低? .
(2)图中△H= kJ?mol-1.
(3)已知恒容时,该体系中各物质浓度随时间变化的曲线如图2所示.
①在0.5L容器中发生反应,前20min内,v(NH3)= ,放出的热量为 .
②45min时采取的措施是 .
③比较I、Ⅱ、Ⅲ时段的化学平衡常数(分别用K1、K2、K3表示)大小 .
(1)图中A、C分别表示
(2)图中△H=
(3)已知恒容时,该体系中各物质浓度随时间变化的曲线如图2所示.
①在0.5L容器中发生反应,前20min内,v(NH3)=
②45min时采取的措施是
③比较I、Ⅱ、Ⅲ时段的化学平衡常数(分别用K1、K2、K3表示)大小

考点:化学平衡的影响因素,反应热和焓变,化学平衡的计算
专题:
分析:(1)根据图象分析,图中A、C分别表示反应物总能量和生成物总能量;根据催化剂降低活化能来判断;
(2)结合已知N2(g)与H2(g)反应生成17g NH3(g),放出46.1kJ的热量,分析图象是合成氨反应N2(g)+3H2(g)=2NH3(g),计算得到;
(3)①根据图象数据,前20min内,v(NH3)=
=
=0.05mol/(L?min);前20min内,生成氨气的物质的量为1mol/L×0.5L=0.5mol,所以放出的热量为0.5×46=23KJ;
②第45分钟时,氨气的浓度变大,氢气和氮气的浓度都变小,说明平衡向正反应方向移动,所以改变的条件是降低体系温度;
③第25分钟时,氨气的浓度由1.00mol/L变为0,说明改变的条件是将NH3从反应体系中分离出去,所以K1=K2,又因为45分钟时,改变的条件是降低体系温度,平衡向正反应方向移动,所以K3>K1=K2.
(2)结合已知N2(g)与H2(g)反应生成17g NH3(g),放出46.1kJ的热量,分析图象是合成氨反应N2(g)+3H2(g)=2NH3(g),计算得到;
(3)①根据图象数据,前20min内,v(NH3)=
| △C |
| △t |
| 1 |
| 20 |
②第45分钟时,氨气的浓度变大,氢气和氮气的浓度都变小,说明平衡向正反应方向移动,所以改变的条件是降低体系温度;
③第25分钟时,氨气的浓度由1.00mol/L变为0,说明改变的条件是将NH3从反应体系中分离出去,所以K1=K2,又因为45分钟时,改变的条件是降低体系温度,平衡向正反应方向移动,所以K3>K1=K2.
解答:
解:(1)根据图象分析,图中A、C分别表示反应物总能量和生成物总能量;因为催化剂降低活化能,所以使用催化剂,会使图中B点降低;
故答案为:反应物总能量;生成物总能量;降低;
(2)已知N2(g)与H2(g)反应生成1mol NH3(g),放出46kJ的热量,图象是表示的是反应N2(g)+3H2(g)=2NH3(g)能量变化,所以生成2mol氨气放热92kJ,热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol;
故答案为:-92;
(3)①根据图象数据,前20min内,v(NH3)=
=
=0.05mol/(L?min);前20min内,生成氨气的物质的量为1mol/L×0.5L=0.5mol,所以放出的热量为0.5×46=23KJ,故答案为:0.050 mol/(L?min); 23 kJ;
②第45分钟时,氨气的浓度变大,氢气和氮气的浓度都变小,说明平衡向正反应方向移动,所以改变的条件是降低体系温度,故答案为;降低体系温度;
③第25分钟时,氨气的浓度由1.00mol/L变为0,说明改变的条件是将NH3从反应体系中分离出去,所以K1=K2,又因为45分钟时,改变的条件是降低体系温度,平衡向正反应方向移动,所以K3>K1=K2,故答案为:K3>K1=K2.
故答案为:反应物总能量;生成物总能量;降低;
(2)已知N2(g)与H2(g)反应生成1mol NH3(g),放出46kJ的热量,图象是表示的是反应N2(g)+3H2(g)=2NH3(g)能量变化,所以生成2mol氨气放热92kJ,热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol;
故答案为:-92;
(3)①根据图象数据,前20min内,v(NH3)=
| △C |
| △t |
| 1 |
| 20 |
②第45分钟时,氨气的浓度变大,氢气和氮气的浓度都变小,说明平衡向正反应方向移动,所以改变的条件是降低体系温度,故答案为;降低体系温度;
③第25分钟时,氨气的浓度由1.00mol/L变为0,说明改变的条件是将NH3从反应体系中分离出去,所以K1=K2,又因为45分钟时,改变的条件是降低体系温度,平衡向正反应方向移动,所以K3>K1=K2,故答案为:K3>K1=K2.
点评:本题考查对能量变化图的分析以及外界条件对化学平衡的影响,以及有关物质的量的计算,题目难度中等.要注意平衡常数只与温度有关.

练习册系列答案
相关题目
加热10.0g碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为8.45g,求混合物中碳酸钠的质量分数( )
| A、42% | B、58% |
| C、36% | D、64% |
在印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后下列结果不可能出现的是( )
| A、烧杯中有铜无铁 |
| B、烧杯中有铁无铜 |
| C、烧杯中铁铜都有 |
| D、烧杯中铁铜都无 |
下列各组离子可能大量共存的是( )
| A、饱和氯水中:Cl-、NO3-、Na+、SO32- |
| B、能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+ |
| C、常温下水电离出的c(H+)?c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32 |
| D、含有大量OH-的无色溶液中:Na+、Cu2+、AlO2-、SiO32- |
下列关于反应过程中能量变化的说法正确的是( )
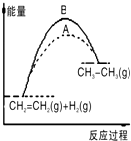

| A、在一定条件下,某可逆反应的△H=+100kJ?mol-1,则该反应正反应活化能比逆反应活化能大100kJ?mol-1 |
| B、图中A、B曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H>0未使用和使用催化剂时,反应过程中的能量变化 |
| C、同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
| D、如图所示的能量变化判断该化学反应是放热反应 |
在室温下,下列叙述正确的是( )
| A、将1mLpH=3的一元酸溶液稀释到10mL,若溶液的pH<4,则此酸为弱酸 |
| B、将1mL1.0×10-5mol/L盐酸稀释到1000mL,溶液的pH=8 |
| C、用pH=1的盐酸分别中和1mLpH=13NaOH溶液和氨水,NaOH消耗盐酸的体积大 |
| D、ph=2的盐酸与pH=1的硫酸比较,c(Cl-)=c(SO42-) |
已知M、W、X、Y、Z为短周期元素,M为形成化合物最多的元素,W、Z同主族,X、Y、Z同周期,Z元素的原子序数为W的2倍,Z的最外层电子数为Y的最外层电子数的2倍,Y的电子层数和最外层电子数相等,W和X能形成X2W和X2W2两种常见化合物,下列说法错误的是( )
| A、W、X、Y形成的简单离子半径大小关系为W>X>Y |
| B、M、W元素形成的简单氢化物的沸点:W>M |
| C、X金属元素是同周期中金属性最强的元素 |
| D、Z的最高价氧化物对应的水化物的浓溶液能与Y在常温下剧烈反应 |