题目内容
金属钛被称为“未来金属”,它具有硬度大,熔点高,耐腐蚀等特点.某工厂以钛铁矿(主要成分FeTiO3)为主要原料,冶炼金属Ti,其工业生产流程如图:
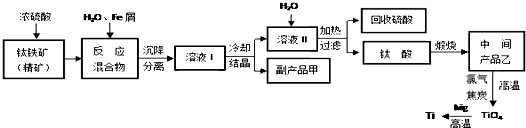
已知:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
回答下列问题:
(1)上述生产流程中加入铁屑的目的是 ,检验副产品甲是否变质的实验方法是 .
(2)由溶液I获得甲晶体,需要经过 操作.除烧杯、漏斗外,过滤操作还要用到另一种玻璃仪器,该仪器在此操作中的主要作用是 .
(3)TiO2变为TiCl4的化学方程式 .但最近用熔融法直接电解中间产品乙制取金属钛获得成功,试比较用电解法生产钛比原工艺的优劣 .
(4)该工艺中消耗33.6LCl2(标况),至少可得 克甲晶体.

已知:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
回答下列问题:
(1)上述生产流程中加入铁屑的目的是
(2)由溶液I获得甲晶体,需要经过
(3)TiO2变为TiCl4的化学方程式
(4)该工艺中消耗33.6LCl2(标况),至少可得
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:分析流程可知,钛铁矿(主要成分FeTiO3)加入浓硫酸后加入水和铁粉还原铁离子沉降分离得到溶液Ⅰ,通过蒸发浓缩,冷却结晶过滤洗涤得到甲晶体硫酸亚铁晶体,和滤液Ⅱ,加入水稀释,加热过滤回收硫酸和钛酸,煅烧得到二氧化钛,与氯气和碳单质高温加热反应生成四氯化钛,加入镁还原得到钛;
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,加入铁屑,可防止Fe2+氧化检验副产品甲是否变质是建议你是否含有铁离子,;
(2)由溶液I获得甲晶体的方法是蒸发冷却析出晶体;
(3)二氧化钛和碳、氯气反应生成四氯化钛和一氧化碳,电解熔融的二氧化钛可以得到金属钛,依据原子利用率、反应过程中的能耗分析判断;
(4)依据反应FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O,TiO2+2C+Cl2=TiCL4+2CO 的定量关系计算.
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,加入铁屑,可防止Fe2+氧化检验副产品甲是否变质是建议你是否含有铁离子,;
(2)由溶液I获得甲晶体的方法是蒸发冷却析出晶体;
(3)二氧化钛和碳、氯气反应生成四氯化钛和一氧化碳,电解熔融的二氧化钛可以得到金属钛,依据原子利用率、反应过程中的能耗分析判断;
(4)依据反应FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O,TiO2+2C+Cl2=TiCL4+2CO 的定量关系计算.
解答:
解:(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,加入铁屑,可防止Fe2+氧化,2Fe3++Fe=3Fe2+,亚铁离子易被氧化为铁离子,检验副产品甲是否变质,只要检验其中是否有铁离子即可,实验方法是:取副产品甲少许溶于水,滴加适量KSCN溶液,观察溶液是否变为血红色,如果变血红色,证明已经变质,否则没变质,
故答案为:防止Fe2+氧化;取副产品甲少许溶于水,滴加适量KSCN溶液,观察溶液是否变为血红色,如果变血红色,证明已经变质,否则没变质;
(2)由溶液I获得甲晶体,需要经过蒸发浓缩,冷却结晶,过滤洗涤得到晶体,除烧杯、漏斗外,过滤操作还要用到另一种玻璃仪器为玻璃棒,玻璃棒在此操作中的主要作用引流作用;
故答案为:蒸发浓缩,冷却结晶,过滤洗涤;玻璃棒,引流作用;
(3)TiO2变为TiCl4的反应是二氧化钛和碳、氯气反应生成,反应的化学方程式为:TiO2+2C+2Cl2=
TiCl4+2CO;煅烧钛酸可以得到二氧化钛,电解熔融的二氧化钛可以得到金属钛,即TiO2
Ti+O2↑,优点:工艺简便且原子利用率高,对环境无污染,缺点:耗能高,
故答案为:TiO2+2C+Cl2=
TiCL4+2CO,优点:工艺简便且原子利用率高,对环境无污染缺点:耗能高;
(4)该工艺中消耗33.6LCl2(标况),物质的量=
=1.5mol,依据反应FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O,TiO2+2C+2Cl2=TiCl4+2CO,
得到FeSO4?7H2O~TiOSO4~TiO2~2Cl2,
1 2
0.75 mol 1.5mol
晶体质量=0.75mol×278g/mol=208.5g;
故答案为:208.5g;
故答案为:防止Fe2+氧化;取副产品甲少许溶于水,滴加适量KSCN溶液,观察溶液是否变为血红色,如果变血红色,证明已经变质,否则没变质;
(2)由溶液I获得甲晶体,需要经过蒸发浓缩,冷却结晶,过滤洗涤得到晶体,除烧杯、漏斗外,过滤操作还要用到另一种玻璃仪器为玻璃棒,玻璃棒在此操作中的主要作用引流作用;
故答案为:蒸发浓缩,冷却结晶,过滤洗涤;玻璃棒,引流作用;
(3)TiO2变为TiCl4的反应是二氧化钛和碳、氯气反应生成,反应的化学方程式为:TiO2+2C+2Cl2=
| ||
| ||
故答案为:TiO2+2C+Cl2=
| ||
(4)该工艺中消耗33.6LCl2(标况),物质的量=
| 33.6L |
| 22.4L/mol |
得到FeSO4?7H2O~TiOSO4~TiO2~2Cl2,
1 2
0.75 mol 1.5mol
晶体质量=0.75mol×278g/mol=208.5g;
故答案为:208.5g;
点评:本题考查物质的制备实验方案的设计,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度中等,注意把握实验的基本原理和物质的性质.

练习册系列答案
相关题目
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的是( )
| A、H2C2O4在反应中被还原 |
| B、ClO2是氧化产物 |
| C、KClO3 在反应中得到电子 |
| D、1 mol KClO3 参加反应有 2 mol 电子转移 |
下列实验方案设计中,可行的是( )
| A、加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铁粉 |
| B、用萃取的方法分离汽油和煤油 |
| C、用溶解和过滤的方法分离硝酸钾和氯化钠固体混合物 |
| D、将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 |
将5mol?L-1的盐酸10mL稀释到200mL,再取出5mL,这5mL溶液的物质的量浓度是( )
| A、0.05 mol?L-1 |
| B、0.25 mol?L-1 |
| C、0.10 mol?L-1 |
| D、0.50 mol?L-1 |
下列物质能通过化合反应直接制得的是( )
①FeCl2 ②H2SO4 ③NH4NO3 ④Fe(OH)3.
①FeCl2 ②H2SO4 ③NH4NO3 ④Fe(OH)3.
| A、只有①②③ | B、只有②③ |
| C、只有①③④ | D、全部 |
根据下列方程式:①2Fe2++Cl2=2Fe3++2Cl-;②HClO+HCl=Cl2+H2O;③2Fe3++Cu=2Fe2++Cu2+;④Fe+Cu2+=Fe2++Cu,下列各组物质氧化性强弱顺序正确的是( )
| A、Fe3+>HClO>Cl2>Fe2+>Cu2+ |
| B、HClO>Cl2>Fe3+>Cu2+>Fe2+ |
| C、Cl2>HClO>Fe3+>Cu2+>Fe2+ |
| D、HClO>Fe3+>Cl2>Cu2+>Fe2+ |

