题目内容
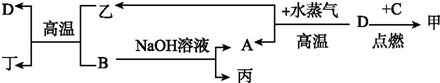
7.有关下列两套装置的描述不正确的是( )
| A. | 甲装置为铁的析氢腐蚀,若将铁换成铜,则甲装置就是铜的吸氧腐蚀 | |
| B. | 若将甲装置中的电流表改为电源,无论电源怎么连接,C电极上都会有气体放出 | |
| C. | 乙装置中K关闭后,a极附近颜色逐渐加深变黑 | |
| D. | 若将乙装置中的NaOH溶液换为HCl溶液,则K关闭后b极颜色变浅 |
分析 A.铜与盐酸不反应,形成原电池反应时发生吸氧腐蚀;
B.C电极若为阳极,则溶液中Cl-放电,生成Cl2,若C电极为阴极,则溶液中的H+放电生成H2;
C.硫化银胶粒带负电荷,向阳极移动;
D.若将乙装置中的NaOH溶液换为HCl溶液,因为镁比铝活泼,所以镁为负极.
解答 解:A.因为铁是氢前金属,所以甲装置为铁的析氢腐蚀,若将铁换成铜,因为铜是氢后金属,则甲装置就是铜的吸氧腐蚀,故A正确;
B.若将甲装置中的电流表改为电源,C电极若为阳极,则溶液中Cl-放电,生成Cl2,若C电极为阴极,则溶液中的H+放电生成H2,故B正确;
C.乙装置中K关闭后,因为Al能与NaOH溶液反应,所以Al为负极,则a为阴极,b为阳极,硫化银胶体属于金属硫化物是带负电的胶体粒子,所以移向阳极,故a极附近颜色逐渐加深变黑是错误的,故C错误;
D.若将乙装置中的NaOH溶液换为HCl溶液,因为镁比铝活泼,所以镁为负极,则a为阳极,b为阴极,则K关闭后硫化银胶体移向a极,b极颜色变浅正确.故D正确.
故选C.
点评 本题考查原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的工作原理,答题时注意:(1)电池问题的解决要以确定电极为第一步,然后按照电极反应的特点进行分析;(2)胶体粒子带电的规律是金属氧化物和金属的氢氧化物带正电,金属硫化物和非金属氧化物带负电,题目难度不大.

练习册系列答案
相关题目
17.下列各组物质之间通过一步反应能实现如图所示转化关系,且与表中条件也匹配的是( )
| 选项 | X | Y | Z | 箭头上为反应条件或试剂 | 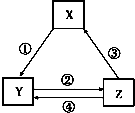 |
| A | Fe | FeCl2 | FeCl3 | ①通入少量Cl2 | |
| B | Na2CO3 | NaCl | NaHCO3 | ②先通CO2、再通过量NH3 | |
| C | SiO2 | Na2SiO3 | H2SiO3 | ③加热 | |
| D | NaAlO2 | Al(OH)3 | Al2O3 | ④加H2O |
| A. | A | B. | B | C. | C | D. | D |
18.将乙醇1mol(其中的羟基氧用 18O 标记)在浓硫酸存在并加热下与足量乙酸充分反应.下列叙述不正确的是( )
| A. | 不可能生成90g 乙酸乙酯 | B. | 生成的乙酸乙酯中含有18O | ||
| C. | 可能生成61.6g 乙酸乙酯 | D. | 生成的水分子中一定含有18O |
19.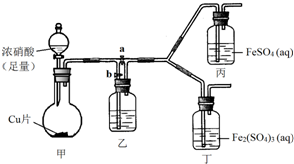 某学生欲通过实验方法验证Fe2+的性质.
某学生欲通过实验方法验证Fe2+的性质.
(1)该同学在实验前,依据Fe2+的还原性,填写了下表.
依照表中操作,该同学进行实验.观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色.
为了进一步探究溶液变成深棕色的原因,该同学进行如下实验.
(2)向原新制FeSO4溶液和反应后溶液中均加入KSCN溶液,前者不变红色,后者(加了数滴浓硝酸的FeSO4溶液)变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
(3)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的.为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.
ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化.
ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应.
ⅲ.为与ⅰ中实验进行对照,更换丙、丁后(溶质不变),使甲中反应继续,观察到的现象与步骤ⅰ中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO)3+2NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤ⅱ的目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由NO或NO2与Fe2+作用得到(或不是由NO或NO2与Fe3+作用得到).
(4)该同学重新进行(1)中实验,观察到了预期现象,其实验操作是向盛有浓硝酸的试管中滴入数滴新制FeSO4溶液,振荡.
 某学生欲通过实验方法验证Fe2+的性质.
某学生欲通过实验方法验证Fe2+的性质.(1)该同学在实验前,依据Fe2+的还原性,填写了下表.
| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO${\;}_{3}^{-}$+2H+=Fe3++NO2↑+H2O |
为了进一步探究溶液变成深棕色的原因,该同学进行如下实验.
(2)向原新制FeSO4溶液和反应后溶液中均加入KSCN溶液,前者不变红色,后者(加了数滴浓硝酸的FeSO4溶液)变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
(3)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的.为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.
ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化.
ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应.
ⅲ.为与ⅰ中实验进行对照,更换丙、丁后(溶质不变),使甲中反应继续,观察到的现象与步骤ⅰ中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO)3+2NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤ⅱ的目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由NO或NO2与Fe2+作用得到(或不是由NO或NO2与Fe3+作用得到).
(4)该同学重新进行(1)中实验,观察到了预期现象,其实验操作是向盛有浓硝酸的试管中滴入数滴新制FeSO4溶液,振荡.
16.某学生欲通过实验验证Fe2+的性质.
(1)该同学在实验前,依据Fe的还原性,填写了下表.
依照表中操作,该同学进行实验,观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色.为探究溶液变为深棕色的原因,该同学进行了如下实验.
(2)向原新制FeSO4溶液和反应后溶液中均加入KSCN溶液,前者不变红色,后者变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
(3)查阅资料,发现溶液的深棕色可能是NO2或NO与溶液中Fe3+或Fe2+发生反应而得到的.为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.
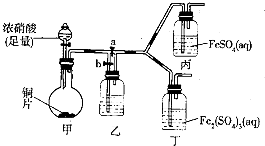
Ⅰ、打开活塞a,关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液并无明显变化.
Ⅱ、打开活塞b、关闭a,一段时间后再停止甲中反应.
Ⅲ、为与I中实验对照,更换丙、丁后,使甲中反应继续,观察到的现象与步骤I中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤II的目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由NO或NO2与Fe2+作用得到(或不是由NO或NO2与Fe3+作用得到).
(4)该同学重新进行(1)中实验,观察到了预期现象,他的实验操作是向盛有浓硝酸的试管中滴入数滴新制FeSO4溶液,振荡.
(1)该同学在实验前,依据Fe的还原性,填写了下表.
| 实验操作 | 预期现象 | 离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3-+2H+=Fe3++NO2↑+H2O |
(2)向原新制FeSO4溶液和反应后溶液中均加入KSCN溶液,前者不变红色,后者变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
(3)查阅资料,发现溶液的深棕色可能是NO2或NO与溶液中Fe3+或Fe2+发生反应而得到的.为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.

Ⅰ、打开活塞a,关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液并无明显变化.
Ⅱ、打开活塞b、关闭a,一段时间后再停止甲中反应.
Ⅲ、为与I中实验对照,更换丙、丁后,使甲中反应继续,观察到的现象与步骤I中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤II的目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由NO或NO2与Fe2+作用得到(或不是由NO或NO2与Fe3+作用得到).
(4)该同学重新进行(1)中实验,观察到了预期现象,他的实验操作是向盛有浓硝酸的试管中滴入数滴新制FeSO4溶液,振荡.
17.对下列物质用途的描述不符合事实的是( )
| A. | 硅酸钠可用作木材防火涂料 | B. | Fe2O3可用作外墙涂料 | ||
| C. | 过氧化钠可用作潜艇供氧剂 | D. | 铝制容器可以贮运稀硝酸 |
 .
.