题目内容
反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的反应速率 v (x)为( )
| A、v (O2)=0.01mol?(L?s) -1 |
| B、v (NO)=0.008mol?(L?s) -1 |
| C、v (H2O)=0.006mol?(L?s) -1 |
| D、v (NH3)=0.002mol?(L?s) -1 |
考点:化学反应速率和化学计量数的关系
专题:化学反应速率专题
分析:根据v=
计算NO的反应速率,再根据各种物质的反应速率之比等于其计量数之比计算其它物质表示的反应速率.
| ||
| △t |
解答:
解:在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则v(NO)=
=0.002mol?(L?s) -1,各种物质的反应速率之比等于其计量数之比,则
v(O2)=
v(NO)=
×0.002 mol/(L?s)=0.0025mol/(L?s),
v(H2O)=
v(NO)=
×0.002 mol/(L?s)=0.003 mol/(L?s),
v(NH3)=v(NO)=0.002mol/(L?s),
故选D.
| ||
| 30s |
v(O2)=
| 5 |
| 4 |
| 5 |
| 4 |
v(H2O)=
| 3 |
| 2 |
| 3 |
| 2 |
v(NH3)=v(NO)=0.002mol/(L?s),
故选D.
点评:本题考查化学反应速率有关计算,难度不大,注意根据定义式理解反应速率规律,注意对公式的理解与灵活应用.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
光纤通信是以光作为信息的载体,制造光导纤维的基本原料是( )
| A、钢 | B、铜 | C、石英砂 | D、铝 |
在强酸性溶液中,可以大量共存的离子组是( )
| A、Na+、K+、CH3COO-、Cl- |
| B、Ba2+、Na+、CO32-、NO3- |
| C、Na+、Ag+、SO42-、Cl- |
| D、Al3+、Fe3+、NO3-、SO42- |
相同体积的氯化钠、氯化镁、氯化铝溶液分别与过量的硝酸银溶液反应,所生成的沉淀物质的量相同,则原氯化钠、氯化镁、氯化铝溶液的物质的量浓度之比为( )
| A、1:2:3 |
| B、3:2:1 |
| C、6:3:1 |
| D、6:3:2 |
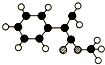 A是生产某新型工程塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图所示(如图中球与球之间连线代表化学键单键或双键).
A是生产某新型工程塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图所示(如图中球与球之间连线代表化学键单键或双键).