题目内容
15.一足条件下有机物X经过下列化学变化后可得到丙酸丙酯(如图),则有机物X是( )
| A. | CH3CH2CH2OH | B. | C3H6 | C. | CH3CH2CHO | D. | CH3CH2COOH |
分析 由转化可知,X与Z发生酯化反应生成丙酸丙酯,则X、Z中均含3个C原子,且Y与氢气发生加成反应,Y能氧化生成Z,则Y为醛,以此来解答.
解答 解:由转化可知,X与Z发生酯化反应生成丙酸丙酯,则X、Z中均含3个C原子,且Y与氢气发生加成反应,Y能氧化生成Z,则Y为醛,可知X为CH3CH2CH2OH,Y为CH3CH2CHO,Z为CH3CH2COOH,
故选A.
点评 本题考查有机物的推断,为高频考点,把握转化中X、Y、Z含相同的C原子及Y为醛为解答的关键,侧重分析与推断能力的考查,注意常见有机物的转化反应,题目难度不大.

练习册系列答案
相关题目
5.已知X3-核外共有a个电子,X原子的质量数为b,则m g X3-含有中子的物质的量为( )
| A. | $\frac{m(b-a-3)}{b}$ | B. | $\frac{(b-a-3)}{mb}$ | C. | $\frac{m(b-a)}{b}$ | D. | $\frac{m(b-a+3)}{b}$ |
3. 汽车尾气中排放的NxOy和CO,科学家寻找高效催化剂实现大气污染物转化:
汽车尾气中排放的NxOy和CO,科学家寻找高效催化剂实现大气污染物转化:
2CO(g)+2NO(g)?N2(g)+2CO2(g)△H1
(1)已知:CO的燃烧热△H2=-283kJ•moL-1.几种化学键的键能数据如下:
已知:N2(g)+O2(g)=2NO(g)△H3,则:△H1=-749kJ•moL-1.
(2)CO与空气在KOH溶液中构成燃料电池(石墨为电极),若放电后电解质溶液中离子浓度大小顺序为
c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),则负极的反应式为2CO-2e-+3OH-=HCO3-+H2O;
(3)在一定温度下,向2L的密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应
4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H<0,相关数据如下:
①5~10min,用CO的浓度变化表示的反应速率为:0.056mol/(L.min)
②能说明上述反应达到平衡状态的是BD
A.2n正(NO2)=n逆(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变D.容器内气体压强不变
③20min时,向容器中加入1.0molNO2和1.0molCO,在t1时刻再次达到平衡时,NO2的转化率比原平衡时变大(填“变大”、“变小”或“不变”).
④计算此温度下的化学平衡常数K=0.11
⑤在上述平衡的基础上,在时间t2、t3时改变反应的某一条件,反应速率的变化如图所示,则在t3时刻改变的反应条件是:降低温度;在时间15-20,t1-t2,t2-t3,t4-t5时的平衡常数分别为K1、K2、K3、K4,请比较各平衡常数的大小关系:K1=K2=K3<K4.
 汽车尾气中排放的NxOy和CO,科学家寻找高效催化剂实现大气污染物转化:
汽车尾气中排放的NxOy和CO,科学家寻找高效催化剂实现大气污染物转化:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H1
(1)已知:CO的燃烧热△H2=-283kJ•moL-1.几种化学键的键能数据如下:
| 化学键 | N≡N键 | O=O键 | N$\stackrel{←}{=}$O键 |
| 键能kJ/•mol-1 | 945 | 498 | 630 |
(2)CO与空气在KOH溶液中构成燃料电池(石墨为电极),若放电后电解质溶液中离子浓度大小顺序为
c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),则负极的反应式为2CO-2e-+3OH-=HCO3-+H2O;
(3)在一定温度下,向2L的密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应
4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H<0,相关数据如下:
| 0min | 5min | 10min | 15min | 20min | |
| c(NO2) | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
| c(N2) | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
②能说明上述反应达到平衡状态的是BD
A.2n正(NO2)=n逆(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变D.容器内气体压强不变
③20min时,向容器中加入1.0molNO2和1.0molCO,在t1时刻再次达到平衡时,NO2的转化率比原平衡时变大(填“变大”、“变小”或“不变”).
④计算此温度下的化学平衡常数K=0.11
⑤在上述平衡的基础上,在时间t2、t3时改变反应的某一条件,反应速率的变化如图所示,则在t3时刻改变的反应条件是:降低温度;在时间15-20,t1-t2,t2-t3,t4-t5时的平衡常数分别为K1、K2、K3、K4,请比较各平衡常数的大小关系:K1=K2=K3<K4.
10.下列不属于配合物的是( )
| A. | [Cu(NH3)4]SO4•H2O | B. | [Ag(NH3)2]OH | C. | NH4NO3 | D. | Na[Al(OH)4] |
12.下列有关酒精的叙述错误的是( )
| A. | 易溶于水 | B. | 易挥发 | C. | 常用作有机溶剂 | D. | 不能燃烧 |
9.现有一瓶A和B的混合液,已知A和B的某些性质如下:
由此,分离A和B的最佳方法是( )
| 物质 | 熔点℃ | 沸点℃ | 密度g•cm-3 | 水溶性 |
| A | -98 | 57.5 | 0.93 | 可溶 |
| B | -84 | 97 | 0.90 | 可溶 |
| A. | 萃取 | B. | 升华 | C. | 分馏 | D. | 分液 |
10.化学与生活密切相关.下列说法正确的是( )
| A. | 棉、蚕丝、合成纤维完全燃烧都只生成CO2和H2O | |
| B. | 牛奶、鸡蛋清均可用于重金属中毒解毒 | |
| C. | 白菜上洒少许福尔马林,既保鲜又消毒 | |
| D. | 氨水能导电,说明氨气是电解质 |
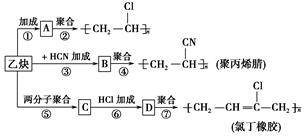

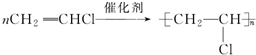 ;
;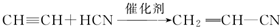 ;
;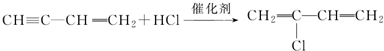 .
. .
.