题目内容
9.物质的类别和核心元素的化合价是研究物质性质的两个基本视角.
(1)图中X的电子式为
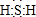 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱O(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.
;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱O(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.(2)Na2S2O3是一种用途广泛的钠盐.
①下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是bd(填字母序号).
a.Na2S+S b.Z+S c.Na2SO3+Y d.NaHS+NaHSO3
②已知反应:Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O.研究其反应速率时,下列说法正确的是b(填写字母序号).
a.可通过测定一段时间内生成SO2的体积,得出该反应的速率
b.可通过比较出现浑浊的时间,研究浓度、温度等因素对该反应速率的影响
c.可通过Na2S2O3固体与稀硫酸和浓硫酸的反应,研究浓度对该反应速率的影响
(3)治理含CO、SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体.
①已知:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ•mol-1
S(s)+O2(g)═SO2(g)△H=-296kJ•mol-1
则治理烟道气反应的热化学方程式为2CO(g)+SO2 (g)═S(s)+2CO2(g)△H=-270 kJ•mol-1.
②一定条件下,将CO与SO2以体积比为4:1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是cd(填写字母序号).
a.v (CO):v(SO2)=2:1
b.平衡常数不变
c.气体密度不变
d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为$\frac{7}{11}$,则SO2的转化率为60%.
分析 (1)X为H2S,S最外层6个电子,能够与2个H原子形成共价键;H2S在空气中变浑浊是因为被氧气氧化为S;同主族元素最外层电子数相同,原子半径自上而下逐渐增大,得电子能力逐渐减弱,失电子能力逐渐增强;
(2)①Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2;
②硫代硫酸钠与稀硫酸反应生成了单质硫,溶液变浑浊,反应速率越快,出现浑浊时间越短;
(3)①利用已知热化学方程式,利用盖斯定律进行书写;
②反应达到平衡状态时正逆反应速率相等,各组分浓度保持不变,据此分析;利用三段式法计算二氧化硫的转化率.
解答 解:(1)X为H2S,S最外层6个电子,能够与2个H原子形成共价键,其电子式为: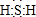 ;H2S在空气中变浑浊是因为被氧气氧化为S,所以S非金属性比O弱;同主族元素最外层电子数相同,原子半径自上而下逐渐增大,得电子能力逐渐减弱,失电子能力逐渐增强,
;H2S在空气中变浑浊是因为被氧气氧化为S,所以S非金属性比O弱;同主族元素最外层电子数相同,原子半径自上而下逐渐增大,得电子能力逐渐减弱,失电子能力逐渐增强,
故答案为: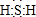 ;弱;电子层数增多,原子半径增大;
;弱;电子层数增多,原子半径增大;
(2)①Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2,a中S化合价都小于2,c中S的化合价都大于2,bd符合题意,
故答案为:bd;
②根据硫代硫酸钠与稀硫酸反应生成了单质硫,溶液变浑浊,可以判断反应速率快慢,反应速率越快,出现浑浊时间越短,
故答案为:b;
(3)①已知:①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ•mol-1
②S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1
据盖斯定律①×2-②得:2CO(g)+SO2 (g)═S(s)+2CO2(g)△H=-270 kJ•mol-1,
故答案为:2CO(g)+SO2 (g)═S(s)+2CO2(g)△H=-270 kJ•mol-1;
②a、CO和SO2的速率之比始终等于化学计量数之比,其无法判断反应是否达到平衡状态,故a错误;
b、温度不变平衡常数始终不变,平衡常数不变不能说明反应达到平衡状态,故b错误;
c、容器体积不变,S为固态,反应正向进行气体体积减小,当气体质量不变时,说明各组分浓度不变,反应达到平衡状态,故c正确;
d、CO2和SO2的体积比保持不变说明正逆反应速率相等,反应达到平衡状态,故d正确;
由 2CO(g)+SO2 (g)═S(s)+2CO2(g)
反应前(mol) 4 1 0 0
转化了(mol)2x x x 2x
平衡后(mol)4-2x 1-x x 2x
混合气体中CO的体积分数为$\frac{7}{11}$,则有$\frac{4-2x}{4-2x+1-x+2x}$=$\frac{7}{11}$,x=0.6,
所以SO2的转化率为$\frac{0.6}{1}$×100%=60%,
故答案为:cd;60%.
点评 本题考查了含硫物质的性质及综合应用,题目难度中等,涉及核外电子的排布与电子式、氧化还原反应、盖斯定律的应用、化学平衡状态的判断、转化率计算等知识,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学计算、化学实验能力.

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案| A. | ①和②等体积混合后的溶液:c(H+)═c(OH-)+c(NH3•H2O) | |
| B. | ①和③等体积混合后的溶液pH约为9.7:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | ①和③等体积混合后的溶液:c(H+)+c(NH4+)═c(OH-)+c(NH3•H2O) | |
| D. | ①和体积为V的③混合后的溶液呈中性:混合后的溶液体积小于2V |
| 周期数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 元素数 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
(2)周期表中第ⅢB族所含元素最多,第ⅣA族元素形成化合物种类最多.
(3)请分析周期数与元素数的关系,预言第8周期最多可能含有元素种数为C.
A.18 B.32 C.50 D.64.
| A. | 向硫化钠中加入少量氯化铁S2-+2 Fe3+═2 Fe2++S↓ | |
| B. | 向Na2FeO4溶液中通入氧气和少量亚硫酸溶液10H++2 FeO42-+SO32-+O2═2Fe3++SO42-+5H2O | |
| C. | 用盐酸酸化的高锰酸钾溶液与过氧化氢反应,证明过氧化氢具有还原性:2 MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| D. | 少量SO2通入苯酚钠溶液中2C6H5O-+SO2+H2O═C6H5OH+SO32- |
 如图所示其反应原理可以表示为4K2CrO4+4H2O$\frac{\underline{\;电解\;}}{\;}$ 2K2Cr2O7+4KOH+2H2↑+O2↑下列说法正确的是( )
如图所示其反应原理可以表示为4K2CrO4+4H2O$\frac{\underline{\;电解\;}}{\;}$ 2K2Cr2O7+4KOH+2H2↑+O2↑下列说法正确的是( )| A. | 随着反应进行,阴极PH逐渐减小 | |
| B. | OH-通过隔膜进入B池 | |
| C. | B池电极发生反应为2H2O+4e-4═H++O2↑ | |
| D. | 每转移2mol电子生成2g H2 |
| A. | C6H14+9O2→CO+5CO2+7H2O | B. | C6H14+7O2→5CO+CO2+7H2O | ||
| C. | C6H14+8O2→3CO+3CO2+7H2O | D. | 2C6H14+15O2→8CO+4CO2+14H2O |
| A. | 难溶电解质沉淀的速率和溶解的速率相等 | |
| B. | 溶液中各离子的浓度不再改变 | |
| C. | 难溶电解质在水中形成饱和溶液 | |
| D. | 加水可使难溶电解质的KSP增大 |