题目内容
17.工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl2•6H2O),其过程为:
已知:Ⅰ.有关氢氧化物沉淀的pH:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(1)操作①中碳酸锶与盐酸反应的离子方程式SrCO3+2H+=Sr2++CO2↑+H2O.
(2)在步骤②-③的过程中,将溶液的pH由1调节至B;宜用的试剂为E.
A.1.5B.3.7 C.9.7 D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体
(3)操作②中加入H2O2发生反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H.
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4. (填化学式).
(5)工业上用热风吹干六水氯化锶,适宜的温度是A.
A.50~60℃B.80~100℃C.100℃以上.
分析 以SrCO3为原料制备六水氯化锶(SrCl2•6H2O),由流程可知,SrCO3和盐酸发生反应:SrCO3+2HCl=SrCl2+CO2↑+H2O,反应后溶液中除含有Sr2+和Cl-外,还含有少量Fe2+、Ba2+杂质,加入过氧化氢,将Fe2+氧化为Fe3+,然后加硫酸生成硫酸钡沉淀,同时调节溶液pH,使Fe3+转化氢氧化铁沉淀,所以过滤后滤渣为硫酸钡和氢氧化铁,滤液中含SrCl2,最后蒸发、冷却结晶得到SrCl2•6H2O,据此分析.
解答 解:(1)碳酸锶与盐酸反应的离子方程式为:SrCO3+2H+=Sr2++CO2↑+H2O;
故答案为:SrCO3+2H+=Sr2++CO2↑+H2O;
(2)由表中数据可知,Fe3+在pH=1.5时开始沉淀,在pH=3.7时沉淀完全,故在步骤②-③的过程中,将溶液的pH值由1调节至3.7,使Fe3+转化氢氧化铁沉淀,且不能引入新杂质,可以选择氢氧化锶粉末;
故答案为:B;E;
(3)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,同时生成水,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)由于前面加入了稀硫酸故有硫酸钡生成,水解可生成氢氧化铁沉淀,所以沉淀有两种即BaSO4、Fe(OH)3;
故答案为:Fe(OH)3、BaSO4;
(5)六水氯化锶晶体61℃时开始失去结晶水,100℃时失去全部结晶水,则用热风吹干六水氯化锶,选择的适宜温度范围是50~60℃;
故答案为:A.
点评 本题考查制备实验方案的设计,理解制备工艺流程原理是解答的关键,涉及物质的分离提纯、操作条件的控制与试剂选择等,注意对题目信息与所学知识的综合应用,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 铅蓄电池在放电过程中,负极质量增加,正极质量也增加 | |
| B. | 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0 | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| D. | 相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱 |
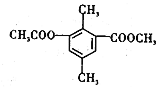
| A. | 分子中不同化学环境的氢共有4种 | |
| B. | 分子中所有的碳原子不可能共平面 | |
| C. | lmol该有机物与足量NaOH溶液反应,最多消耗3mol NaOH | |
| D. | 能发生取代、消去、加成和氧化反应 |
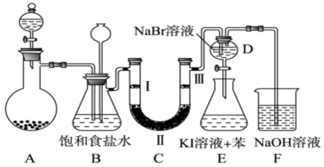
(1)固体二氧化锰和浓盐酸制备氯气的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中锥形瓶水位下降,长颈漏斗中液面上升,形成水柱.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.(填序号)
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的化学方程式2NaOH+Cl2=NaCl+NaClO+H2.
| A. |  和CH3CH=CH2 和CH3CH=CH2 | B. | 淀粉和纤维素 | ||
| C. | CH3CH2CH2CH3和CH3CH2CH3 | D. | 乙烷和乙酸 |
| A. | pH=7的溶液 | |
| B. | c(H+)=c(OH-)=10-6mol/L溶液 | |
| C. | 醋酸钠溶液 | |
| D. | 酸与碱恰好完全反应生成正盐的溶液 |
| A. | CuCl2溶液 | B. | Fe(OH)3沉淀 | C. | 油水混合物 | D. | 稀豆浆 |