题目内容
11. 据报道,摩托罗拉公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH$?_{放电}^{充电}$K2CO3+6H2O
据报道,摩托罗拉公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH$?_{放电}^{充电}$K2CO3+6H2O请填空:
(1)充电时:①原电池的负极与电源负极相连②阳极的电极反应为4OH--4e-═2H2O+O2↑.
(2)在此过程中若完全反应,乙池中B极的质量增加648g,则甲池中理论上消耗O233.6L(标准状况下).
分析 (1)充电时,原电池负极与电源负极相连,阳极上失电子发生氧化反应;
(2)乙池中B极上银离子得电子发生还原反应,根据转移电子相等计算氧气的体积.
解答 解:(1)①充电时,原电池负极与电源负极相连,阳极上氢氧根离子失电子发生氧化反应,电极反应式为:4OH--4e-═2H2O+O2↑,
故答案为:负;4OH--4e-═2H2O+O2↑;
(2)乙池中B极上银离子得电子发生还原反应,当乙池中B极的质量升高648g,则甲池中理论上消耗O2体积=$\frac{\frac{648g}{108g/mol}×1}{4}$=33.6L,
故答案为:33.6.
点评 本题考查了原电池和电解池原理,注意电极反应式的书写要结合电解质溶液的酸碱性,串联电路中转移电子相等.

练习册系列答案
相关题目
1.下列各溶液中,Na+物质的量浓度最小的是( )
| A. | 40mL 0.5mol•L-1 NaCl溶液 | B. | 10 mL 0.3 mol•L-1Na2SO4溶液 | ||
| C. | 50mL 0.4 mol•L-1 NaOH溶液 | D. | 20mL 0.15 mol•L-1 Na3PO4溶液 |
2.下列离子方程式正确的是( )
| A. | 单质铜与浓硝酸反应:Cu+2H++2NO3-═Cu2++2NO2↑+H2O | |
| B. | 氯气与氢氧化钠浓溶液反应:Cl2+OH-═Cl-+ClO-+H2O | |
| C. | 向次氯酸钙溶液中通入过量的CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| D. | 氯化铵溶液与氢氧化钠溶液混合加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑ |
19.将25.6g Cu完全溶于500mL 4mol/L的浓硝酸中,收集到氮的氧化物(含NO、NO2)的混合物共0.6mol,在反应混合液中加入500mL NaOH溶液恰好使铜离子沉淀完全,则NaOH的浓度为( )
| A. | 1.6mol/L | B. | 2mol/L | C. | 2.8 mol/L | D. | 4 mol/L |
20.在铜的冶炼过程中有如下反应发生5FeS2+14CuSO4+12H2O═7Cu2S+5FeSO4+12H2SO4关于此反应,下列说法正确的是( )
| A. | Cu2S既是氧化产物,又是还原产物 | |
| B. | 产物中的SO42-有一部分是氧化产物 | |
| C. | FeS2只作还原剂 | |
| D. | 5 mol FeS2发生反应,有10 mol电子转移 |
1.丙烷的分子结构可简写成键线式结构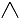 ,有机物A的健线式结构为
,有机物A的健线式结构为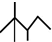 ,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )
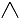 ,有机物A的健线式结构为
,有机物A的健线式结构为 ,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )| A. | 有机物A的一氯取代物只有5种 | |
| B. | 用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷 | |
| C. | 有机物A的分子式为C8H18 | |
| D. | B的结构可能有3种,其中一种名称为2,2,3-三甲基-2-戊烯 |