��Ŀ����
7������������Ԫ��X��Y��Z��W��ԭ��������������Xԭ�ӵĵ��Ӳ����͵���������ȣ�Y��Zͬ���������ڣ�X��Y��Z����Ԫ�ؿ����γɻ�����Q��25��ʱ��0.01mol•L-1Q��Һ��pH=2��Wԭ�ӵ�K���M���������ȣ�����˵����ȷ���ǣ�������| A�� | �����Ӱ뾶��Y��Z��W | |
| B�� | X��Y����Ԫ�ؿ��γɶ��ֶ�Ԫ������ | |
| C�� | X��Z��W����Ԫ���γɵĻ���������ǿ����� | |
| D�� | Ԫ�صķǽ����ԣ�X��Y��Z |
���� ����������Ԫ��X��Y��Z��W��ԭ��������������Xԭ�ӵĵ��Ӳ����͵���������ȣ���XΪHԪ�أ�Wԭ�ӵ�K���M���������ȣ���W����3�����Ӳ㣬����㺬��2�����ӣ�ΪMgԪ�أ�X��Y��Z����Ԫ�ؿ����γɻ�����Q��25��ʱ��0.01mol•L-1Q��Һ��pH=2����QΪһԪǿ�ᣬ����Y��Zͬ���������ڣ���QΪ���ᣬYΪN��ZΪOԪ�أ��ݴ˽��н��
��� �⣺����������Ԫ��X��Y��Z��W��ԭ��������������Xԭ�ӵĵ��Ӳ����͵���������ȣ���XΪHԪ�أ�Wԭ�ӵ�K���M���������ȣ���W����3�����Ӳ㣬����㺬��2�����ӣ�ΪMgԪ�أ�X��Y��Z����Ԫ�ؿ����γɻ�����Q��25��ʱ��0.01mol•L-1Q��Һ��pH=2����QΪһԪǿ�ᣬ����Y��Zͬ���������ڣ���QΪ���ᣬYΪN��ZΪOԪ�أ�
A��N��O��MgԪ�صļ����Ӷ�����2�����Ӳ㣬�˵����Խ�����Ӱ뾶ԽС��������Ӱ뾶��W��Z��Y����A����
B��X��Y�ֱ�ΪH��NԪ�أ����߿����γɰ������£�N2H4���������ᣨHN3���ȶ��ֶ�Ԫ�������B��ȷ��
C��X��Z��W�γɵĻ�����Ϊ������þ��������þ����ǿ����ʣ���C����
D��X��Y��Z�ֱ�ΪH��N��OԪ�أ�HԪ�طǽ�����������N��Oλ��ͬһ���ڣ�ԭ������N��O����ǽ�����N��O������Ԫ�صķǽ����ԣ�X��Y��Z����D����
��ѡB��
���� ���⿼��ԭ�ӽṹ��Ԫ�������ɵĹ�ϵ����Ŀ�ѶȲ����ƶ�Ԫ��Ϊ���ؼ���ע����������ԭ�ӽṹ��Ԫ�������ɡ�Ԫ�����ڱ��Ĺ�ϵ������������ѧ���ķ���������������������

 ��һ������ĩ�ٷֳ�̾�ϵ�д�
��һ������ĩ�ٷֳ�̾�ϵ�д�| A�� | ������H2O��g����CO��H2���ʵ������ | B�� | ������������ܶȲ��ٸı� | ||
| C�� | ����n mol CO��ͬʱ����n mol H2 | D�� | v����H2O��=v����CO�� |
| A�� | 18 g D2O��18 g H2O�к��е���������Ϊ10 NA | |
| B�� | 22.4 LC02�к��й��ۼ���Ŀ4 NA | |
| C�� | ��H2O2�ֽ������0.1mol����ת�Ƶĵ�����Ϊ0.2 NA | |
| D�� | ͬ�¡�ͬѹͬ�����CO��NO���еĵ�������� |
| A�� | ���͡��ȷ¡��Ҵ��� | B�� | �������֡������ǡ��������� | ||
| C�� | �������͡��Ҷ��� | D�� | �ʰ��ᡢ������ϩ������ |
| A�� | CH3CH2CH2CH2CH3 | B�� |  | ||
| C�� |  | D�� |  |
��1����֪����1mol��ѧ������������������CO�Ļ�ѧ�����Ʊ�ʾΪCO����
| ��ѧ�� | C��O | C=O | C-H | H-H |
| ����/kJ•mol-1 | 1074 | 803 | 413 | 436 |
��2����T��ʱ�������4L���ܱ�������ͨ��6mol CO2��6mol CH4���ڴ��������·�����Ӧ��CO2��g��+CH4��g��?2CO��g��+2H2��g������ƽ��ʱH2���������Ϊ0.4��������������ͬʱ����2mol CO2��6molCH4��4molCO��8molH2��������ƽ�����淴Ӧ�������Ӧ�����淴Ӧ���������ƶ���
��3��CH4/CO2������Ӧͨ������ѧ����ɵõ���ͼ��֮һ��ͼ1��ʵ����������C��H2O��g�������ɣ�����̼�ķ�Ӧ֮һΪCH4��g��?C��s��+2H2��g����600��֮��C�����ʵ������٣����÷���ʽ��ʾC���ٵ�ԭ��C+CO2$\frac{\underline{\;\;��\;\;}}{\;}$2CO��
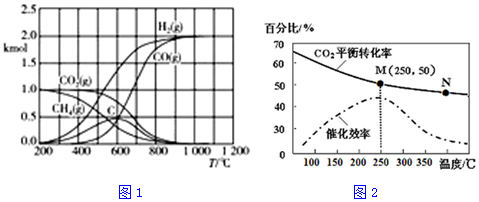
��4����ͬ�¶ȶ�CO2��ת���ʼ�������Ч��Ӱ����ͼ2��ʾ�������й�˵������ȷ���Ǣ٢ڢܣ�����ţ���
�ٲ�ͬ�����·�Ӧ��N����������
���¶ȵ���250��ʱ�����¶�������ϩ�IJ�������
��M��ʱƽ�ⳣ����N��ʱƽ�ⳣ����
��ʵ�ʷ�ӦӦ�������ڽϵ͵��¶��½��У������CO2��ת����
��5����֪ij�¶���CO2��g��+CH4��g��?2CO��g��+2H2��g����ƽ�ⳣ��ΪK1
H2O��g��+CH4��g��?CO��g��+3H2��g����ƽ�ⳣ��ΪK2
C��s��+H2O��g��?2CO��g��+2H2��g����ƽ�ⳣ��ΪK3
��ӳC��g��+CO2��g��?2CO��g�� ��ƽ�ⳣ��ΪKΪ$\frac{{K}_{3}{•K}_{1}}{{K}_{2}}$����K1��K2��K3��ʾ��
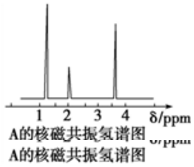
| A�� | CH3CH2CH3 | B�� | CH3CHO | C�� | CH3CH2OH | D�� | CH3CH2CH2COOH |
 Ԫ�ظ���Cr������Һ����Ҫ��Cr3+������ɫ����Cr��OH��4-����ɫ����Cr2O72-���Ⱥ�ɫ����CrO42-����ɫ������ʽ���ڣ�Cr��OH��3Ϊ������ˮ�Ļ���ɫ���壬�ش��������⣺
Ԫ�ظ���Cr������Һ����Ҫ��Cr3+������ɫ����Cr��OH��4-����ɫ����Cr2O72-���Ⱥ�ɫ����CrO42-����ɫ������ʽ���ڣ�Cr��OH��3Ϊ������ˮ�Ļ���ɫ���壬�ش��������⣺