题目内容
14.下列物质,①NaCl 晶体 ②CO2 ③H2SO4溶液 ④石墨 ⑤新制氯水⑥熔融KCl ⑦蔗糖 ⑧CaCO3固体 ⑨醋酸(填编号)(1)能导电的物质是③④⑤⑥
(2)属于强电解质的是①⑥⑧
(3)属于非电解质的是②⑦
(4)请写出其中一种弱电解质的电离方程是CH3COOH?CH3COO-+H+.
分析 在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里和熔融状态下都不导电的化合物是非电解质,含有自由移动电子或离子的物质能导电,据此解答即可.
解答 解:①NaCl 晶体不能导电,溶于水或熔融状态下能完全导电,属于强电解质;
②CO2 本身不能电离,溶于水能导电的原因是生成的碳酸导电,二氧化碳属于非电解质;
③H2SO4溶液 能导电,属于混合物,既不是电解质也不是非电解质;
④石墨能导电,属于单质,既不是电解质也不是非电解质;
⑤新制氯水能导电,属于混合物,既不是电解质也不是非电解质;
⑥熔融KCl能导电,完全电离,属于强电解质;
⑦蔗糖不能导电,属于非电解质;
⑧CaCO3固体不能导电,熔融状态下能导电,完全电离,属于强电解质;
⑨醋酸不能导电,溶于水能导电,属于电解质,醋酸的电离方程式为:CH3COOH?CH3COO-+H+,部分电离,属于弱电解质,
故答案为:(1)③④⑤⑥;(2)①⑥⑧;(3)②⑦;(4)CH3COOH?CH3COO-+H+.
点评 本题考查了电解质和非电解质的判断、电离方程式的书写、离子方程式的书写等知识点,根据概念来分析解答即可,注意醋酸的电离方程式要写可逆号,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列有关化学科学的说法中正确的是( )
| A. | 化学是科学研究的内容,与普通百姓的生活没有关系 | |
| B. | 化学研究只能认识分子,不能制造分子 | |
| C. | 化学家可以制造出自然界中不存在的物质 | |
| D. | 化学研究只会造成严重的环境污染,最终人类将毁灭在化学物质中 |
5.当光束通过下列分散系时,可观察到丁达尔效应的是( )
| A. | 硅酸溶胶 | B. | 氯化钠溶液 | C. | 氯化铁溶液 | D. | 硫酸铜溶液 |
2. 普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )
 普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )| A. | 能与FeCl3溶液发生显色反应 | |
| B. | 1mol该物质与1molBr2发生加成反应,产物有2种 | |
| C. | 能发生加成、取代、消去反应 | |
| D. | 1mol该物质最多可与1molNaOH反应 |
19.在化学反应 A(g)+3B(g)?2C (g)+D(g)中,A、B、C、D的平均反应速率分别为v1、v2、v3、v4,则下列关系正确的是( )
| A. | v1=v2 | B. | v1=2v3 | C. | v3=3v2 | D. | v1=v4 |
6.下列说法正确的是( )
| A. | 活化分子间发生的碰撞就是有效碰撞 | |
| B. | 增大反应物浓度会加快反应速率,原因是增大了活化分子百分数,从而使有效碰撞次数增加 | |
| C. | 吸热反应,升高温度,v正增大,v逆减小 | |
| D. | 有气体参与的反应达到平衡后,增大压强,平衡可能不移动 |
7.连二亚硫酸钠(Na2S2O4),是印刷工业中重要的还原剂.某小组进行如下实验:
Ⅰ.【查阅资料】
(1)连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.
(2)2Na2S2O4+4HCl=4NaCl+S↓+3SO2↑+2H2O;Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O.
Ⅱ.【制备方法】
75℃时将甲酸钠和纯碱加入乙醇水溶液中,通入SO2进行反应,完成其反应方程式:
HCOONa+1Na2CO3+4SO2□=2Na2S2O4+3CO2+□
冷却至40~50℃,过滤,用乙醇洗涤,干燥制得Na2S2O4.
Ⅲ.【Na2S2O4的性质】
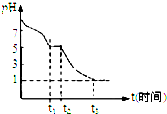
(1)Na2S2O4溶液在空气中易被氧化.课题小组测定0.050mol/LNa2S2O4溶液在空气中pH变化如图所示:0~t1段主要先生成HSO3-,0~t1段发生反应的离子反应方程式为2S2O42-+O2+2H2O=4HSO3-.
t3时溶液中主要阴离子是SO42-.
(2)隔绝空气加热Na2S2O4固体完全分解,得到固体产物Na2SO3、Na2S2O3和气体为SO2(填化学式).
请你设计实验验证产物有Na2S2O3存在,完成下表中内容.
(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、KMnO4溶液)
(3)资料显示:保险粉、H2O2均可用于纸浆漂白.写出保险粉与过量的H2O2,在水溶液中反应生成硫酸盐等物质的离子方程式:S2O42-+3H2O2=2SO42-+2H++2H2O_.
Ⅰ.【查阅资料】
(1)连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.
(2)2Na2S2O4+4HCl=4NaCl+S↓+3SO2↑+2H2O;Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O.
Ⅱ.【制备方法】
75℃时将甲酸钠和纯碱加入乙醇水溶液中,通入SO2进行反应,完成其反应方程式:
HCOONa+1Na2CO3+4SO2□=2Na2S2O4+3CO2+□
冷却至40~50℃,过滤,用乙醇洗涤,干燥制得Na2S2O4.
Ⅲ.【Na2S2O4的性质】

(1)Na2S2O4溶液在空气中易被氧化.课题小组测定0.050mol/LNa2S2O4溶液在空气中pH变化如图所示:0~t1段主要先生成HSO3-,0~t1段发生反应的离子反应方程式为2S2O42-+O2+2H2O=4HSO3-.
t3时溶液中主要阴离子是SO42-.
(2)隔绝空气加热Na2S2O4固体完全分解,得到固体产物Na2SO3、Na2S2O3和气体为SO2(填化学式).
请你设计实验验证产物有Na2S2O3存在,完成下表中内容.
(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、KMnO4溶液)
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取少量完全分解的固体产物于试管中,加入稀盐酸 | 若有淡黄色沉淀,则有Na2S2O3存在 |
8.常温下,在10mL 0.2mol/L氨水中,滴入0.2mol/L的稀盐酸,使溶液的pH=7.则下列说法正确的是( )
| A. | 加入盐酸的体积大于10 mL | B. | c(NH4+)=c(Cl-) | ||
| C. | 加入盐酸的体积等于10 mL | D. | c(NH4+)<c(Cl-) |

 ;⑨的离子结构示意图为
;⑨的离子结构示意图为 .
.