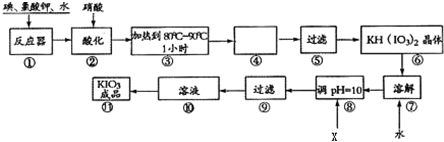
题目内容
将一定质量Mg、Zn、Al的混合物与足量稀H2SO4反应,生成H22.8L(标准状况),则原混合物的质量不可能是( )
| A、2g | B、4g | C、6g | D、8g |
考点:有关混合物反应的计算
专题:极端假设法
分析:三种金属中产生等量的氢气时消耗金属质量最大的为Zn,质量最小的为Al,故假设金属全部为锌可求金属质量为8.125g,假设金属全部为铝可求的金属质量为2.25g,则混合金属的实际质量应介于2.25g~8.125g之间,据此进行判断原混合物不可能的质量.
解答:
解:标况下2.8L氢气的物质的量为:n(H2)═
=0.125mol,
Mg、Zn、Al中产生等量的氢气,消耗金属质量最大的为锌、质量最小的为铝,
故假设金属全部为锌,消耗金属质量为:0.125mol×65g/mol=8.125g,
假设金属全部为铝可求的金属质量为0.125mol×
×27g/mol=2.25g,
则混合金属的实际质量m应应该满足:2.25g<m<8.125g,所以不可能的为A,
故选A.
| 2.8L |
| 22.4L/mol |
Mg、Zn、Al中产生等量的氢气,消耗金属质量最大的为锌、质量最小的为铝,
故假设金属全部为锌,消耗金属质量为:0.125mol×65g/mol=8.125g,
假设金属全部为铝可求的金属质量为0.125mol×
| 2 |
| 3 |
则混合金属的实际质量m应应该满足:2.25g<m<8.125g,所以不可能的为A,
故选A.
点评:本题考查混合物的计算,题目难度中等,可用极端假设法解答,极端假设法是用数学方法解决化学问题的常用方法,一般解答有关混合物计算时采用,可分别假设原混合物是某一纯净物,进行计算,确定最大值、最小值,再进行分析、讨论、得出结论.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法中正确的是( )
| A、所有主族元素中,氟的电负性最大 |
| B、钠的第一电离能比镁的第一电离能大 |
| C、第三周期所包含的元素中钠的原子半径最小 |
| D、电子云示意图中的每个小黑点都表示一个电子 |
下列有关实验的叙述中,正确的是( )


| A、实验①中,石墨棒附近的溶液变红色 |
| B、实验②中,上层固体物质是高级脂肪酸 |
| C、实验③中,黑色的氧化铜被乙醇还原成红色的铜 |
| D、实验④中,所用试液只能是含待测元素的盐溶液 |
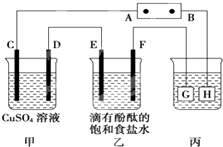 如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.