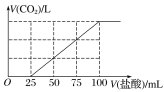
题目内容
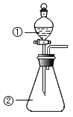
【题目】钒基固溶体合金是一类重要的贮氢材料。某课外小组采用廉价原料 NH4VO3、TiO2 和 Fe2O3,制出含 VO2+、TiO2+和 Fe3+的金属盐溶液,然后选择氨水作沉淀剂进行共沉淀反应(有 氨气逸出),对共沉淀物[含 VO(OH)2、Ti(OH)4、Fe(OH)3]进行煅烧还原制备合金样品。制备共沉 淀物的装置如图:

(1)实验中用浓氨水配制 500mL 2 mol·L-1 的稀氨水,需用到的玻璃仪器有烧杯、胶头滴管、玻璃 棒和_____、_____。
(2)装置 B 的作用是_________________________________________________。
(3)制备 VO2+时,用草酸(H2C2O4)将 VO2+还原得 VO2+。若把草酸改为盐酸,也能得到 VO2+, 但会产生一种有毒气体,该反应的离子方程式为_____。
(4)反应过程需控制温度为 60℃,三颈烧瓶的加热方式是_________________。
(5)往三颈烧瓶中滴加含金属离子的混合液,得悬浊液,取出充分沉降。
①检测上层清液是否含 Fe3+的实验方案是___________。
②经过滤、无水乙醇洗涤、低温干燥,得共沉淀物。使用无水乙醇洗涤的优点是_____。
【答案】500 ml容量瓶 量筒 吸收尾气中的氨气并防止倒吸 2VO2++4H+ +2C1- =2VO2+ +2H2O+Cl2↑ 水浴加热 取少量上层清液与试管中,加入KSCN溶液,观察溶液是否变成血红色 乙醇易挥发容易干燥,减少洗涤时因固体溶解而损失
【解析】
(1)实验中用浓氨水配制 500mL 2 mol·L-1的稀氨水,需要用量筒量取浓氨水的体积,在烧杯中用玻璃棒搅拌溶解,冷却后,用玻璃棒引流转移至500ml容量瓶,用蒸馏水洗涤烧杯和玻璃棒两到三次,洗涤液转移至500 ml容量瓶,要用胶头滴管进行定容。需用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、500 ml容量瓶和量筒,
答案为:500 ml容量瓶;量筒;
(2)选择氨水作沉淀剂进行共沉淀反应(有氨气逸出),装置 B 的作用是吸收尾气中的氨气并防止倒吸,
答案为:吸收尾气中的氨气并防止倒吸;
(3由信息可知盐酸将VO2+还原为VO2+ ,还生成氯气,由电子守恒、电荷守恒及原子守恒可知离子反应为2VO2++4H+ +2C1- =2VO2+ +2H2O+Cl2↑,答案为:2VO2++4H+ +2C1- =2VO2+ +2H2O+Cl2↑;
(4)反应过程需控制温度为60°C ,三颈烧瓶的加热方式应该为60°C水浴加热,
答案为:水浴加热;
(5)①检测上层清液是否含Fe3+的实验方案是取少量上层清液与试管中,加入KSCN溶液,观察溶液是否变成血红色,故答案为:取少量上层清液与试管中,加入KSCN溶液,观察溶液是否变成血红色;
②使用无水乙醇洗涤的优点是乙醇易挥发容易干燥、减少洗涤时因固体溶解而损失,
故答案为:乙醇易挥发容易干燥,减少洗涤时因固体溶解而损失。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案