题目内容
7.下列实验和分析正确的是( )| A. | 无色溶液中加入AgNO3溶液得白色沉淀,加稀盐酸不消失,可能存在Cl-或SO42- | |
| B. | 无色溶液中滴加BaCl2溶液得白色沉淀,加稀硝酸不溶解,则一定含有SO42- | |
| C. | 用CCl4萃取碘水中的碘,下层呈紫红色 | |
| D. | 加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32- |
分析 A、氯化银、硫酸钡是白色的不溶于硝酸的沉淀;
B、无色溶液中滴加BaCl2溶液得白色沉淀,加稀硝酸不溶解,沉淀可以是氯化银还可以是硫酸钡;
C、用CCl4萃取碘水中的碘,碘单质在四氯化碳中的溶解度更大;
D、能和盐酸反应产生二氧化碳气体的可以是碳酸根还可以是碳酸氢根离子等.
解答 解:A、无色溶液中加入AgNO3溶液得白色沉淀,加稀盐酸不消失,可能存在Cl-或SO42-、SO32-,故A错误;
B、无色溶液中滴加BaCl2溶液得白色沉淀,加稀硝酸不溶解,则含有硫酸根离子或是银离子中的至少一种,故B错误;
C、用CCl4萃取碘水中的碘,碘单质在四氯化碳中的溶解度更大,四氯化碳和水互不相溶,密度大于水,所以下层呈紫红色,故C正确;
D、加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中有大量碳酸根离子、碳酸氢根离子等离子中的至少一种,故D错误.
故选C.
点评 本题考查了常见离子的检验方法,题目难度中等,注意掌握常见离子的性质及检验方法,明确离子检验时,必须排除干扰离子,确保检验方案的严密性.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案
相关题目
15.下列四种试剂均需密封保存,密封保存的原因,其中一种与其它三种不同. 这种试剂是( )
| A. | 浓盐酸 | B. | 浓硫酸 | C. | 浓氨水 | D. | 苯 |
2.实验室中一般采用醇与溴化钠以及浓硫酸混合反应制备溴代烃,实验室制备溴乙烷和1-溴丁烷均用此原理.有关数据列表如表;请回答下列问题:
(1)请写出制溴乙烷的有关反应方程式2CH3CH2OH+2NaBr+H2SO4$\stackrel{△}{→}$2CH3CH2Br+2H2O+Na2SO4;
(2)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在下层(填“上层”、“下层”或“不分层”).
(3)制备操作中,加入的浓硫酸必需进行稀释,目的是abc.(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是c.(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于平衡向生成溴乙烷的方向移动;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷和正丁醇的沸点相差不大.
| 乙醇 | 溴乙烷 | 1-丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(2)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在下层(填“上层”、“下层”或“不分层”).
(3)制备操作中,加入的浓硫酸必需进行稀释,目的是abc.(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是c.(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于平衡向生成溴乙烷的方向移动;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷和正丁醇的沸点相差不大.
19.某种可降解的高分子材料(如图)的单体是( )


| A. |  | B. |  | ||
| C. |  | D. |  |
12.在容积为2L的密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)?2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如下图所示.下列说法正确的是( )
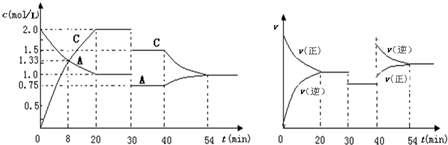

| A. | 0~20min用A物质表示反应的平均速率为0.005mol•L-1•min-1 | |
| B. | 该反应的正反应为吸热反应 | |
| C. | x=1,且30min时改变的反应条件是减压 | |
| D. | 在25min、35min、55min时化学平衡常数分别为K1、K2、K3,则K3>K2>K1 |
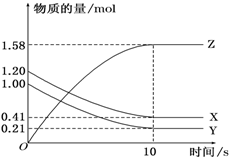 一定温度下,某1L体积固定的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,请回答下列问题:
一定温度下,某1L体积固定的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,请回答下列问题: