题目内容
(1)已知:①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ/mol②CH3OH(g)+
| 3 |
| 2 |
由上述方程式可知:CH3OH的燃烧热
(2)用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池.电池充放电时的总反应为:NiO(OH)+MH
| 放电 |
| 充电 |
(3)硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2.
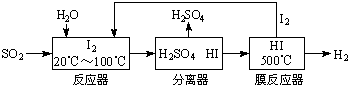
已知1g FeS2完全燃烧放出7.1kJ热量,FeS2燃烧反应的热化学方程式为
分析:(1)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物所放出的热量,液态水比气态水能量低,更稳定,可利用盖斯定律计算反应热;
(2)NiO(OH)+MH
Ni(OH)2+M,放电为原电池,正极发生还原反应,依据电池反应书写电极反应,以此来解答;
(3)根据1g FeS2完全燃烧放出7.1kJ热量,结合热化学方程式的书写方法来回答;
根据该循环的工艺流程目的和原料进行分析解答.
(2)NiO(OH)+MH
| 放电 |
| 充电 |
(3)根据1g FeS2完全燃烧放出7.1kJ热量,结合热化学方程式的书写方法来回答;
根据该循环的工艺流程目的和原料进行分析解答.
解答:解:(1)因燃烧热在某一温度和压强下lmol某物质完全燃烧生成稳定氧化物时所释放出的热量,而H2O的稳定化合物是液态水,H2O蒸汽转变为液态水需要放热,所以CH3OH的燃烧热大于192.9kJ/mol;
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+
O2(g)═CO2(g)+2H2O(g)△H=-192.9kJ/mol
③H2O(l)=H2O(g)△H=+44kJ/mol
由盖斯定律(②-①)-③×3得 3H2(g)+3/2O2(g)=3H2O(g)△H=-373.9kJ/mol 即H2(g)+
O2(g)=H2O(l)△H=-124.6kJ/mol,
故答案为:大于;H2(g)+
O2(g)=H2O(l)△H=-124.6kJ/mol;
(2)放电过程是原电池反应,正极发生还原反应,电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH-;
故答案为:NiO(OH)+H2O+e-=Ni(OH)2+OH-;
(3)4 mol FeS2的质量为m(FeS2)=4 mol×120 g?mol-1=480 g,因为1g FeS2完全燃烧放出7.1kJ热量所以存在
4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)Q
1g 7.1kJ
480g Q′
解 Q′=3408 kJ
所以该反应的热化学方程式为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3408 kJ?mol-1,
故答案为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3408 kJ?mol-1;
(2)在反应器中发生反应:SO2+I2+2H2O=2HI+H2SO4,在膜反应器中的反应为:2HI?I2+H2,将两个方程式相加得:SO2+2H2O=H2SO4+H2,
故答案为:SO2+2H2O=H2SO4+H2.
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+
| 3 |
| 2 |
③H2O(l)=H2O(g)△H=+44kJ/mol
由盖斯定律(②-①)-③×3得 3H2(g)+3/2O2(g)=3H2O(g)△H=-373.9kJ/mol 即H2(g)+
| 1 |
| 2 |
故答案为:大于;H2(g)+
| 1 |
| 2 |
(2)放电过程是原电池反应,正极发生还原反应,电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH-;
故答案为:NiO(OH)+H2O+e-=Ni(OH)2+OH-;
(3)4 mol FeS2的质量为m(FeS2)=4 mol×120 g?mol-1=480 g,因为1g FeS2完全燃烧放出7.1kJ热量所以存在
4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)Q
1g 7.1kJ
480g Q′
解 Q′=3408 kJ
所以该反应的热化学方程式为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3408 kJ?mol-1,
故答案为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3408 kJ?mol-1;
(2)在反应器中发生反应:SO2+I2+2H2O=2HI+H2SO4,在膜反应器中的反应为:2HI?I2+H2,将两个方程式相加得:SO2+2H2O=H2SO4+H2,
故答案为:SO2+2H2O=H2SO4+H2.
点评:本题主要考查了热化学方程式的书写以及盖斯定律的运用,原电池和电解池原理,题目综合性强,考点为高考热门考点,难度中等.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目


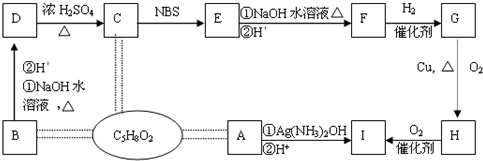
 ,模仿以下流程图设计合成路线,标明每一步的反应物及反应条件.(有机物写结构简式,其它原料自选)
,模仿以下流程图设计合成路线,标明每一步的反应物及反应条件.(有机物写结构简式,其它原料自选) ;C:CH2=CH-CH=CH2-CH3;D:
;C:CH2=CH-CH=CH2-CH3;D: ;E:
;E: F:CH≡CH;G:CH3-C≡CH; H:CH3-C≡C-CH3
F:CH≡CH;G:CH3-C≡CH; H:CH3-C≡C-CH3 ,若要合成
,若要合成 ,则下列所选原料正确的是
,则下列所选原料正确的是



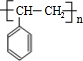
 (主要产物),1mol某烃A充分燃烧后可以得到8mol CO2和4mol H2O.该烃A在不同条件下能发生如下所示的一系列变化.
(主要产物),1mol某烃A充分燃烧后可以得到8mol CO2和4mol H2O.该烃A在不同条件下能发生如下所示的一系列变化.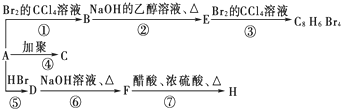
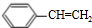
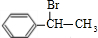
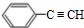
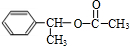
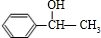 +NaBr
+NaBr