题目内容
18.铝土矿(主要成分为Al2O3,还有少量杂质)是提取氧化铝的原料.提取氧化铝的工艺流程如图:
(1)请用离子方程式表示以上工艺流程中第①步反应:Al2O3+2OH-═2AlO2-+H2O.
(2)写出以上工艺流程中第③步反应的化学方程式:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3.
(3)金属铝与氧化铁混合在高温下,会发生剧烈的反应.该反应的化学方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.请举一例该反应的用途焊接铁轨.
分析 由实验流程可知,①中氧化铝与NaOH反应而溶解,而杂质不反应,过滤除去杂质,③中二氧化碳与溶液反应生成氢氧化铝和碳酸氢钠,过滤得到氢氧化铝,再灼烧、电解得到金属Al,以此来解答.
解答 解:(1)Ai2O3和氢氧化钠反应生成偏铝酸钠和水,反应的实质是:Al2O3+2OH-═2AlO2-+H2O,故答案为:Al2O3+2OH-═2AlO2-+H2O;
(2)向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀和碳酸氢钠,发生的反应为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,
故答案为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;
(3)金属铝在高温下可以和氧化铁发生铝热反应,获得金属铁,铁以铁水的形式生成,这样可以来焊接钢轨,反应的方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;焊接铁轨.
点评 本题考查物质分离提纯实验方案的设计,为高频考点,把握实验流程中的反应及分离方法为解答的关键,注意氧化铝、氢氧化铝两性的分析,题目难度不大.

练习册系列答案
相关题目
8.下列电子式书写不正确的是( )
| A. | 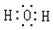 | B. | 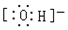 | C. | 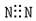 | D. | 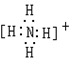 |
9.由一种阳离子和两种酸根离子组成的盐称为混盐.下列关于混盐Na4S2O3的有关判断,不正确的是( )
| A. | 该混盐能使高锰酸钾酸性溶液褪色 | |
| B. | 该混盐溶液加入BaCl2可以生成沉淀 | |
| C. | 该混盐与H2SO4反应有气体生成 | |
| D. | 该混盐在酸性条件下可生成S,每产生1molS转移1.5NA个电子 |
6.在1000K时,已知反应Ni(s)+H2O(g)?NiO(s)+H2(g)的平衡常数K=0.0059.当水蒸气和氢气的物质的量浓度相等时,此反应( )
| A. | 已达平衡状态 | B. | V正>V逆 | ||
| C. | 未达平衡状态,平衡逆向移动 | D. | 无法确定是否达到平衡状态 |
13.关于电解氯化钠溶液,下列叙述正确的是( )
| A. | 电解时在正极得到氯气,在负极得到金属钠 | |
| B. | 若在正极附近有黄绿色的气体产生 | |
| C. | 若在负极附近的溶液中滴入酚酞溶液,溶液呈无色 | |
| D. | 电解一段时间后,将电解液全部转移到烧杯中,充分搅拌后溶液呈中性 |
3.在25℃的纯水中通入一定量的氯化氢,当溶液的pH=1时,则由水电离出的c(H+)是( )
| A. | 1×10-1mol/L | B. | 1×10-6mol/L | C. | 1×10-3mol/L | D. | 1×10-13mol/L |
10.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K与温度T的关系如表:
请回答下列问题:
(1)该反应为吸热反应.(填“吸热”或“放热”)
(2)830℃,c(CO)=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L,c(H2)=0.05mol/L,该反应否(填“是”或“否”)达到的化学平衡状态.
(3)800℃时,固定容积的密闭容器中,放入混合物,起始浓度为c(CO)=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L,c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率比生成速率小(填“大”、“小”或“不能确定”)
(4)830℃时,在1L的固定容积的密闭容器中放入2mol CO2和1mol H2,平衡后CO2的转化率为$\frac{1}{3}$,H2的转化率为$\frac{2}{3}$(用分数表示).若再充入1mol H2则H2的转化率为减小(增大,减少,不变)
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为吸热反应.(填“吸热”或“放热”)
(2)830℃,c(CO)=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L,c(H2)=0.05mol/L,该反应否(填“是”或“否”)达到的化学平衡状态.
(3)800℃时,固定容积的密闭容器中,放入混合物,起始浓度为c(CO)=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L,c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率比生成速率小(填“大”、“小”或“不能确定”)
(4)830℃时,在1L的固定容积的密闭容器中放入2mol CO2和1mol H2,平衡后CO2的转化率为$\frac{1}{3}$,H2的转化率为$\frac{2}{3}$(用分数表示).若再充入1mol H2则H2的转化率为减小(增大,减少,不变)
7.在下列变化中,需要加入合适的氧化剂才能实现的是( )
| A. | KMnO4→O2 | B. | CO 2→CO | C. | Fe2O 3→Fe | D. | Br→Br2 |
8.CPAE是蜂胶的主要活性成分,由咖啡酸合成CPAE路线如图:
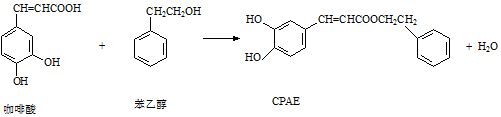
下列说法正确的是( )

下列说法正确的是( )
| A. | 苯乙醇属于芳香醇,它与邻甲基苯酚互为同系物 | |
| B. | 1 mol CPAE最多可与含3 mol NaOH的溶液发生反应 | |
| C. | 不能用FeCl3溶液可以检测上述反应中是否有CPAE生成 | |
| D. | 咖啡酸、苯乙醇及CPAE都能发生取代、加成和消去反应 |