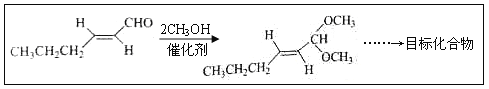
��Ŀ����
����Ŀ����Ʒ�ˮ�г�����������A���ŷ�ǰ�ɼ�CuSO4��Һ������ʹ֮ת��Ϊ����B�����������̽���ʵ�顣
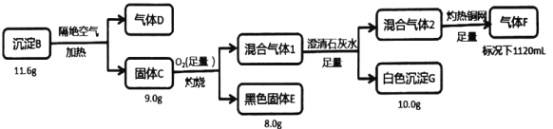
��֪��B������Ԫ�أ�����D������ܶ�2.32g/L���������l��ɫ��ζ������F������ܶ�Ϊ1.25g/L����ش�
��1�����B������Ԫ����___������D�ķ���ʽ��___��
��2��д������C���������������յķ���ʽ___��
��3������C�ڷ��ڵ�ϡ�����л�����һ�������һ�ְ�ɫ�������ð�ɫ�����ǹ��ۻ�������������Ϊ199)����Ӧ�Ļ�ѧ����ʽ��___��
���𰸡�Cu��C��N (CN)2 2CuCN��3O2![]() 2CuO��2CO2��N2 2CuCN+2HCl
2CuO��2CO2��N2 2CuCN+2HCl![]() Cu2Cl2+2HCN
Cu2Cl2+2HCN
��������
��Ʒ�ˮ�г�����������A���ŷ�ǰ�ɼ�CuSO4��Һ������ʹ֮ת��Ϊ����B������B���Ժ���ͭԪ�أ������������Ⱥ�Ĺ���CӦ��ͭԪ�أ����պ��ɫ����EӦΪCuO 8.0g��CuO�����ʵ���=![]() =0.1mol������Cu�غ㣬B��C��CuԪ�ص����ʵ���0.1mol��CuԪ������Ϊ0.1mol��64g/mol=6.4g��C������O2���պ�����Ļ������1ͨ����������ʯ��ˮ������10g��ɫ����G����GΪCaCO3���������1�к���CO2��δ��Ӧ��O2������C�غ㣬����C�к��к���CԪ�أ������ʵ���Ϊ
=0.1mol������Cu�غ㣬B��C��CuԪ�ص����ʵ���0.1mol��CuԪ������Ϊ0.1mol��64g/mol=6.4g��C������O2���պ�����Ļ������1ͨ����������ʯ��ˮ������10g��ɫ����G����GΪCaCO3���������1�к���CO2��δ��Ӧ��O2������C�غ㣬����C�к��к���CԪ�أ������ʵ���Ϊ![]() =0.1mol������Ϊ0.1mol��12g/mol=1.2g����Ӧ��Ļ������2��ͨ�����ȵ�ͭ����ȫ��Ӧ��ʣ��1120mL����F���������F������ܶ�Ϊ1.25g/L������FĦ������Ϊ1.25g/L��22.4L/mol =28g/mol���Ʋ�ΪN2�����������ʵ���=
=0.1mol������Ϊ0.1mol��12g/mol=1.2g����Ӧ��Ļ������2��ͨ�����ȵ�ͭ����ȫ��Ӧ��ʣ��1120mL����F���������F������ܶ�Ϊ1.25g/L������FĦ������Ϊ1.25g/L��22.4L/mol =28g/mol���Ʋ�ΪN2�����������ʵ���=![]() =0.05mol������Ϊ0.05mol��28g/mol=1.4g������ת�����̷�������FΪN2����Cu��C��NԪ�ض������ڹ���C����C��Cu��C��N����Ԫ����ɣ��ٸ���m(Cu)+ m(C)+ m(N)=6.4g+1.2g+1.4g=9g���պõ��ڲ��뷴Ӧ�Ĺ���C���������ɴ˿�ȷ����FΪN2��C��Cu��C��N����Ԫ����ɣ���n(Cu)��n(C)��n(N)=0.1mol��0.1mol��0.05mol��2=1��1��1�������C�Ļ�ѧʽΪCuCN���������1ΪCO2��O2��N2�Ļ�����壬�������2ΪO2��N2�Ļ�����壻���ڳ���BҲ��������Ԫ����ɣ������������ȷֽ�ΪC��D��û������Ԫ�أ���BҲ����Cu��C��N����Ԫ����ɣ�BΪ11.6g��CΪ9g�����������غ㣬D������Ϊ2.6g������D������ܶ�2.32g/L����DĦ������Ϊ2.32g/L��22.4L/mol��52g/mol���� ����D�����ʵ���Ϊ
=0.05mol������Ϊ0.05mol��28g/mol=1.4g������ת�����̷�������FΪN2����Cu��C��NԪ�ض������ڹ���C����C��Cu��C��N����Ԫ����ɣ��ٸ���m(Cu)+ m(C)+ m(N)=6.4g+1.2g+1.4g=9g���պõ��ڲ��뷴Ӧ�Ĺ���C���������ɴ˿�ȷ����FΪN2��C��Cu��C��N����Ԫ����ɣ���n(Cu)��n(C)��n(N)=0.1mol��0.1mol��0.05mol��2=1��1��1�������C�Ļ�ѧʽΪCuCN���������1ΪCO2��O2��N2�Ļ�����壬�������2ΪO2��N2�Ļ�����壻���ڳ���BҲ��������Ԫ����ɣ������������ȷֽ�ΪC��D��û������Ԫ�أ���BҲ����Cu��C��N����Ԫ����ɣ�BΪ11.6g��CΪ9g�����������غ㣬D������Ϊ2.6g������D������ܶ�2.32g/L����DĦ������Ϊ2.32g/L��22.4L/mol��52g/mol���� ����D�����ʵ���Ϊ![]() 0.05mol��C�г�Cu���CN-������Ϊ9g-6.4g=2.6g��CN-�����ʵ���Ϊ
0.05mol��C�г�Cu���CN-������Ϊ9g-6.4g=2.6g��CN-�����ʵ���Ϊ![]() =0.1mol��B�г�Cu�������Ϊ11.6-6.4=5.2g����B�Ļ�ѧʽΪCu(CN)2��ǰ��ķ�����ȷ����B�к���Cu0.1mol����B�к���CN-�����ʵ���Ϊ0.2mol������ԭ���غ㣬D�к���CNΪ0.1mol����D�ķ���ʽΪ(CN)2���ݴ˷������
=0.1mol��B�г�Cu�������Ϊ11.6-6.4=5.2g����B�Ļ�ѧʽΪCu(CN)2��ǰ��ķ�����ȷ����B�к���Cu0.1mol����B�к���CN-�����ʵ���Ϊ0.2mol������ԭ���غ㣬D�к���CNΪ0.1mol����D�ķ���ʽΪ(CN)2���ݴ˷������
(1)���ݷ��������B������Ԫ����Cu��C��N��Ԫ�أ�����D�ķ���ʽ��(CN)2��
(2)����CΪCuCN����������������������CuO��CO2��N2����ʽ2CuCN��3O2![]() 2CuO��2CO2��N2��
2CuO��2CO2��N2��
(3)CuCN�����ᷴӦ��������ΪHCN����������Ħ���������ƶ���ΪCu2Cl2����2CuCN+2HCl![]() Cu2Cl2+2HCN��
Cu2Cl2+2HCN��

 ״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�