题目内容
18.下列说法正确的是( )| A. | SO2和Cl2都能使品红溶液褪色,且加热后均恢复原色 | |
| B. | SiO2是酸性氧化物,能与NaOH溶液反应 | |
| C. | 紫色石蕊试液滴入SO2水溶液中,先变红后褪色 | |
| D. | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,则该溶液中一定含有SO42- |
分析 A、二氧化硫的漂白作用加热后恢复,氯气的和水反应生成的次氯酸漂白作用加热不恢复;
B、酸性氧化物和碱反应生成盐和水;
C、紫色石蕊试液滴入SO2水溶液中,只变红不褪色;
D、溶液中可能有银离子.
解答 解:A、二氧化硫结合有机色素形成不稳定无色物质加热后恢复红色,氯气和水反应生成的次氯酸具有强氧化性,漂白作用不可恢复,故A错误;
B、SiO2是酸性氧化物,能与NaOH溶液反应生成硅酸钠和水,故B正确;
C、二氧化硫不漂白紫色石蕊试液,所以只变红不褪色,故C错误;
D、溶液中可能有银离子,检验硫酸根离子,应先加盐酸酸性,然后加入氯化钡,故D错误;
故选B.
点评 本题考查了物质性质的分析判断,二氧化硫、二氧化硅、氯离子的检验应用,掌握基础是关键,题目较简单.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
9.下列过程属于物理变化的是( )
| A. | 石油的分馏 | B. | 石油的裂化 | C. | 煤的干馏 | D. | 乙烯聚合 |
6.海边的铁制品比较容易生锈,月球上的铁不易腐蚀.钢铁发生腐蚀时,正极上发生的反应为( )
| A. | 2Fe-4e-═2Fe2+ | B. | 2Fe2++4e-═2Fe | ||
| C. | 2H2O+O2+4e-═4OH- | D. | 2Fe3++2e-═2Fe2+ |
13.2010年5月2日,某煤矿发生瓦斯爆炸事故,造成多人伤亡,因此在矿井里,必须采取安全措施,如通风、严禁烟火等,而且要随时检查瓦斯的体积分数,如果空气中含甲烷5%~15.4%,遇明火会发生爆炸.发生最强烈爆炸时空气中甲烷所占的体积分数是( )
| A. | 5% | B. | 9.1% | C. | 10.5% | D. | 15.4% |
3.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 25℃,pH=12的NaOH溶液中含有OH-的数目为0.01 NA | |
| B. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,在该反应中,当有3NA电子转移时,上述热化学反应方程式的焓变为△H=-46.2KJ/mol | |
| C. | 2.3g金属钠与过量氧气充分反应,无论加热与否转移电子数为0.1NA | |
| D. | 50mL 18.4mo1/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
10.下列离子方程式书写正确的是( )
| A. | Ca(HCO3)2 溶液中滴入过量NaOH溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 向NaAlO2 溶液中通入过量的 CO2:CO2+2H2O+A1O2-═Al(OH)3↓+HCO3- | |
| C. | 0.01mol/L NH4Al(SO4)2 溶液与 0.02mol/L Ba(OH)2 溶液等体积混合:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| D. | 向Ca(ClO)2 溶液中通入过量的 SO2:C1O-+SO2+H2O═HClO+HSO3- |
 .
. ,该有机物与H2加成时最多能消耗氢气的物质的量3mol,有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式
,该有机物与H2加成时最多能消耗氢气的物质的量3mol,有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式 ,将Y加入酸性高锰酸钾溶液中的现象酸性高锰酸钾溶液褪色.
,将Y加入酸性高锰酸钾溶液中的现象酸性高锰酸钾溶液褪色.
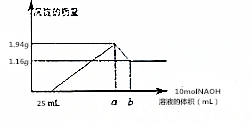 将一定质量的镁和铝合金粉末溶解于50mL某浓度的盐酸中,等合金全部溶解后,再向其中加入某浓度的NaOH溶液,在此过程中,产生沉淀的质量与所需要消耗NaOH溶液的体积关系如图所示,试回答下列问题:
将一定质量的镁和铝合金粉末溶解于50mL某浓度的盐酸中,等合金全部溶解后,再向其中加入某浓度的NaOH溶液,在此过程中,产生沉淀的质量与所需要消耗NaOH溶液的体积关系如图所示,试回答下列问题: