题目内容
10.农村有句谚语:“雷雨肥庄稼”.请写出有关的化学方程式N2+O2 $\frac{\underline{\;放电\;}}{\;}$2NO;2NO+O2=2NO2;3NO2+H2O=2HNO3+NO.分析 在放电条件下,氮气跟氧气能直接化合生成无色的一氧化氮气体;一氧化氮不溶于水,在常温下易跟空气中的氧气化合,生成红棕色的二氧化氮气体;二氧化氮易溶于水,它溶于水后生成硝酸和一氧化氮,据此分析解答.
解答 解:“雷雨发庄稼”,空气中的N2在放电条件下与O2直接化合生成无色且不溶于水的一氧化氮气体,N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO;
一氧化氮的密度比空气略大,不稳定,常温下就易与空气中的O2反应生成红棕色的二氧化氮气体,2NO+O2=2NO2;
二氧化氮气体有毒,易与水反应生成硝酸(HN03)和一氧化氮,3NO2+H2O=2HNO3+NO;
生成的硝酸随雨水淋洒到大地上,同土壤中的矿物相互作用,生成可溶于水的硝酸盐可作氮肥,植物生长得更好;
故答案为:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO;2NO+O2=2NO2;3NO2+H2O=2HNO3+NO.
点评 本题主要考查了氮气、一氧化氮、二氧化氮的化学性质,理解反应原理、正确书写化学方程式是解答的关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.有8种物质:①庚烷 ②苯 ③乙酸乙酯 ④溴苯 ⑤四氯化碳 ⑥环己烷 ⑦1,2-二溴乙烷 ⑧乙醇,加入溴水后分层,且颜色层在上层的是( )
| A. | ①②③⑥ | B. | ①②⑤⑦⑧ | C. | ①②③ | D. | ①②④⑥ |
1.下列有关实验说法正确的是( )
| A. | 在“镀锌铁皮厚度测量”实验中,当锌在酸中完全溶解后,产生氢气的速率会显著减慢,可借此判断镀锌铁皮中锌镀层是否完全反应 | |
| B. | 用标准NaOH溶液测定食醋总酸含量时应该使用甲基橙作为指示剂 | |
| C. | 硫酸亚铁铵晶体制备实验的最后一步是将溶液蒸发到有大量晶体析出,用余热蒸干即可得产物 | |
| D. | 将3-4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸,检验火柴头中是否含有氯元素 |
18.氯化硼的熔点为10.7℃,在氯化硼分子中,Cl-B-Cl键角为120℃,它可以水解,水解产物之一是硼酸(H3BO3).下列有磁氯化硼的叙述正确的是( )
| A. | 氯化硼是原子晶体 | B. | 熔化时,氯化硼能导电 | ||
| C. | 氯化硼分子是一种非极性分子 | D. | 氯化硼水解得到两种弱酸 |
15. 乳酸(2-羟基丙酸)为无色液体,与水混溶,弱挥发性.它在多种生物化学过
乳酸(2-羟基丙酸)为无色液体,与水混溶,弱挥发性.它在多种生物化学过
程中起作用.某学习小组研究利用发酵法制乳酸以及探讨乳酸的部分性质.
C6H12O6(葡萄糖)$\stackrel{乳酸菌}{→}$2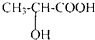
实验(一):乳酸的制取
步骤1:取14.40g葡萄糖(相对分子质量为180)于烧杯中,加入乳酸菌(厌氧)发酵,72
小时后,过滤,将滤液转移到仪器A中,定容,得到500mL原液;
步骤2:取20.00mL原液于锥形瓶中,加入酚酞作指示剂,1)'!浓度为0.1000mol/L的NaOH
溶液滴定至终点,重复4次,数据记录如下表.(假定原液中其他物质不与NaOH反应)
(1)仪器A是500mL容量瓶;
(2)如何判断已到达滴定终点当滴入最后一滴标准液时,锥形瓶中无色溶液变红色,且半分钟内不褪色;
(3)乳酸的产率为30%
实验(二):乳酸的性质
已知乳酸的Ka=1.4x 10-4,碳酸的Ka1=4.47x 10-7
(4)设计实验证明乳酸是弱酸:取0.1mol/L乳酸溶液于烧杯中,用PH计测定其PH值,若PH大于1,说明乳酸是弱酸或(常温下取0.1mol/L乳酸钠溶液于烧杯中,用pH计测定其PH值,若PH大于7,说明乳酸是弱酸)或(取PH=a乳酸溶液于烧杯中,加水稀释10n倍,用PH计测定其PH值,若PH小于a+n说明乳酸是弱酸);
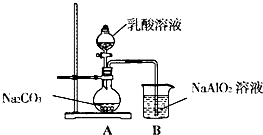
(5)小组利用下图所示的仪器和药品,通过实验来比较乳酸与碳酸的酸性强弱.
①可观察到烧杯中的现象是溶液出现白色浑浊,写出烧杯中发生的化学反应方程式2NaAlO2+3H2O+CO2═2Al(OH)3↓+Na2CO3或NaAlO2+2H2O+CO2═Al(OH)3↓+NaHCO3;
②学习小组中有成员提出上述实验设计不够严谨,请你提出改进的措施在A与B之间增加一个装有碳酸氢钠溶液的洗气瓶.
 乳酸(2-羟基丙酸)为无色液体,与水混溶,弱挥发性.它在多种生物化学过
乳酸(2-羟基丙酸)为无色液体,与水混溶,弱挥发性.它在多种生物化学过程中起作用.某学习小组研究利用发酵法制乳酸以及探讨乳酸的部分性质.
C6H12O6(葡萄糖)$\stackrel{乳酸菌}{→}$2
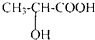
实验(一):乳酸的制取
步骤1:取14.40g葡萄糖(相对分子质量为180)于烧杯中,加入乳酸菌(厌氧)发酵,72
小时后,过滤,将滤液转移到仪器A中,定容,得到500mL原液;
步骤2:取20.00mL原液于锥形瓶中,加入酚酞作指示剂,1)'!浓度为0.1000mol/L的NaOH
溶液滴定至终点,重复4次,数据记录如下表.(假定原液中其他物质不与NaOH反应)
| 次数 | 1 | 2 | 3 | 4 |
| 滴定体积(mL) | 19.22 | 19.18 | 19.80 | 19.20 |
(2)如何判断已到达滴定终点当滴入最后一滴标准液时,锥形瓶中无色溶液变红色,且半分钟内不褪色;
(3)乳酸的产率为30%
实验(二):乳酸的性质
已知乳酸的Ka=1.4x 10-4,碳酸的Ka1=4.47x 10-7
(4)设计实验证明乳酸是弱酸:取0.1mol/L乳酸溶液于烧杯中,用PH计测定其PH值,若PH大于1,说明乳酸是弱酸或(常温下取0.1mol/L乳酸钠溶液于烧杯中,用pH计测定其PH值,若PH大于7,说明乳酸是弱酸)或(取PH=a乳酸溶液于烧杯中,加水稀释10n倍,用PH计测定其PH值,若PH小于a+n说明乳酸是弱酸);
(5)小组利用下图所示的仪器和药品,通过实验来比较乳酸与碳酸的酸性强弱.
①可观察到烧杯中的现象是溶液出现白色浑浊,写出烧杯中发生的化学反应方程式2NaAlO2+3H2O+CO2═2Al(OH)3↓+Na2CO3或NaAlO2+2H2O+CO2═Al(OH)3↓+NaHCO3;
②学习小组中有成员提出上述实验设计不够严谨,请你提出改进的措施在A与B之间增加一个装有碳酸氢钠溶液的洗气瓶.
19.X、Y是同周期非金属元素,已知X原子比Y原子的原子半径大,则下列叙述正确的是( )
| A. | X的最高价氧化物对应的水化物的酸性比Y的强 | |
| B. | X的阴离子比Y的阴离子的还原性强 | |
| C. | X原子的得电子能力比Y原子强 | |
| D. | X的气态氢化物比Y的气态氢化物稳定 |
20. 已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如下所示,1mol 该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为( )
已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如下所示,1mol 该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为( )
 已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如下所示,1mol 该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为( )
已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如下所示,1mol 该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为( )| A. | 5 mol | B. | 6 mol | C. | 7 mol | D. | 8 mol |
 .
.
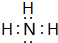 ,含有共价键化学键,E的电子表达式是
,含有共价键化学键,E的电子表达式是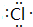 .
. .
.


