题目内容
(1)写出下列物质的结构式.
N2 ,CO2 ,NH3 ,CCl4 .
(2)写出下列物质的电子式.
NH4Cl ,KOH ,Na2O2 .H2O2 .
N2
(2)写出下列物质的电子式.
NH4Cl
考点:电子式,结构式
专题:
分析:(1)氮气分子中存在氮氮三键;
二氧化碳中存在两个碳氧双键;
氨气中存在三个氮氢键;
四氯化碳为正四面体结构,分子中存在四个碳氯键,
(2)氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起;
KOH中钾离子与氢氧根离子通过离子键结合,氢氧根离子内部氧原子与氢原子通过共用1对电子形成共价键;
过氧化钠中两个钠离子与过氧根离子通过离子键结合,两个氧原子通过共用1对电子结合;
双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合.
二氧化碳中存在两个碳氧双键;
氨气中存在三个氮氢键;
四氯化碳为正四面体结构,分子中存在四个碳氯键,
(2)氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起;
KOH中钾离子与氢氧根离子通过离子键结合,氢氧根离子内部氧原子与氢原子通过共用1对电子形成共价键;
过氧化钠中两个钠离子与过氧根离子通过离子键结合,两个氧原子通过共用1对电子结合;
双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合.
解答:
解:(1)氮气分子中存在氮氮三键,结构式为:N≡N;
二氧化碳中存在两个碳氧双键,结构式为:O=C=O;
氨气中存在三个氮氢键,结构简式为: ;
;
四氯化碳为正四面体结构,分子中存在四个碳氯键,结构式为: ;
;
故答案为:N≡N;O=C=O; ;
; ;
;
(2)
氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ;
;
氢氧化钾中存在钾离子和氢氧根离子,氢氧化钾的电子式为: ;
;
Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为 ;
;
双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ;
;
故答案为: ;
; ;
; ;
;
二氧化碳中存在两个碳氧双键,结构式为:O=C=O;
氨气中存在三个氮氢键,结构简式为:
 ;
;四氯化碳为正四面体结构,分子中存在四个碳氯键,结构式为:
 ;
;故答案为:N≡N;O=C=O;
 ;
; ;
;(2)
氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为:
 ;
;氢氧化钾中存在钾离子和氢氧根离子,氢氧化钾的电子式为:
 ;
;Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为
 ;
;双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为:
 ;
;故答案为:
 ;
; ;
; ;
;
点评:本题考查了结构式和电子式的书写,题目难度不大,分清物质所含化学键的类型是解题关键.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
某气体物质,经测定其蒸气密度折合成标准状况为1.63g/L.该化合物可能是下列的( )
| A、HCl |
| B、H2S |
| C、CH4 |
| D、C2H6 |
氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是( )
| A、1mol/L甲酸溶液的pH约为3 |
| B、HCN中滴入石蕊试液,溶液显示为红色 |
| C、10mL 1mol/L HCN恰好与10 mL 1mol/L NaOH溶液完全反应 |
| D、用HCN溶液做导电性实验,灯泡很暗 |
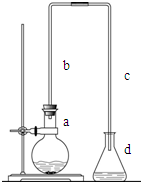 实验室用如图装置制取少量溴苯,试填写下列空白.
实验室用如图装置制取少量溴苯,试填写下列空白.
 A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如图所示.A为地壳中含量仅次于氧的非金属元素的单质.请填空:
A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如图所示.A为地壳中含量仅次于氧的非金属元素的单质.请填空: :
: